
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.请填写下列空白.
(1)E元素基态原子的核外电子排布式为 .
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为(填元素符号),其原因为 .
(3)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为;1mol B2A4分子中含molσ键.
(4)已知D、E能形成晶胞如图所示的两种化合物 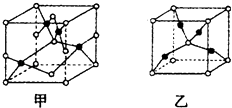 ,化合物的化学式,甲为 , 乙为;高温时,甲易转化为乙的原因为 .
,化合物的化学式,甲为 , 乙为;高温时,甲易转化为乙的原因为 .
【答案】
(1)1s22s22p63s23p63d104s1
(2)C<O<N;同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,其第一电离能大于氧元素
(3)sp2;5
(4)CuO;Cu2O;Cu2O中Cu原子d轨道为全满状态,比较稳定
【解析】解:A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B原子核外有6个电子,则B为C元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4 , 所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素,(1)E为Cu元素,基态原子的核外电子排布式为:1s22s22p63s23p63d104s1 , 所以答案是:1s22s22p63s23p63d104s1;(2)同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值由小到大的顺序为C<O<N,所以答案是:C<O<N;同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,其第一电离能大于氧元素;(3)C2H4分子中C原子有3个σ键,无孤电子对,轨道的杂化类型为sp2杂化,1个C2H4分子中含有5个σ键,1个1个π键,lmolC2H4分子中σ键5mol,所以答案是:sp2;5;(4)已知O、Cu能形成晶胞如图所示的两种化合物,甲中黑色球数目=4,白色球数目=6× ![]() +8×
+8× ![]() =4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8×
=4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8× ![]() =2,黑色球与白色球个数之比为2:1,氧元素为﹣2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙, 所以答案是:CuO;Cu2O;Cu2O中Cu原子d轨道为全满状态,比较稳定.
=2,黑色球与白色球个数之比为2:1,氧元素为﹣2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙, 所以答案是:CuO;Cu2O;Cu2O中Cu原子d轨道为全满状态,比较稳定.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是
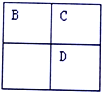
A. 简单离子的半径大小关系:B>C>E
B. 由C、E两种元素组成的两种离子化合物中,阴、阳离子个数比均为1:2
C. C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故
D. 已知A、B两种元素组成的离子化合物NH5与水生成气体A2及一种弱碱溶液,推出离子化合物NH5中阴、阳离子个数比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期。下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物。下列分析正确的是()
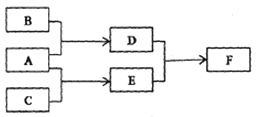
A. 离子半径;Y>Z B. Z的含氧酸均为强酸
C. 与Y同周期氢化物中D最稳定 D. F含离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同一周期也不在同一主族,D的氢化物及其最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (选“A”或“D”)。
(2)元素C在元素周期表中的位置是 ,B的最高价氧化物对应的水化物的电子式为 。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为 。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德常数,下列说法正确的是
A. 在同温同压时,相同体积的任何气体单质所含的原子数目相同
B. 2g氢气所含原子数目为NA
C. 在常温常压下,11.2L氮气所含的原子数目为NA
D. 17g氨气所含电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )
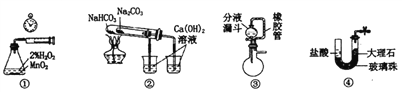
A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO﹣+H+ , 要使溶液中 ![]() 比值增大,可以采用的措施是( )
比值增大,可以采用的措施是( )
A.加少量CH3COONH4固体
B.加浓醋酸
C.加少量NaCl固体
D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:
(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
(2)上述由CO2合成CH2=CH2的反应在________下自发进行(填“高温”或“低温”)。
(3)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是________。

A.平衡常数大小:KMN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象。___________
随时间变化的图象。___________

Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:

(5)放电时,正极的电极反应式为__________________。
(6)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g。
(7)选用高氯酸钠四甘醇二甲醚做电解液的优点是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼是重要的化工原料。可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5℃,熔点为-107.3℃;
②2B+6HCl![]() BCl3+3H2 ,硼也能与强碱反应。
BCl3+3H2 ,硼也能与强碱反应。
某研究性学习小组用如下所示装置制备三氯化硼。回答下列问题:
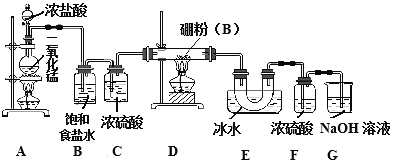
(1)A装置中反应的离子方程式_______________________。
(2)B装置的作用是____________;如果拆去B装置,可能的后果是__________________。
(3)D装置中发生反应的化学方程式_____________。
(4)G装置的作用是_____;为使实验装置简便,可用一个装置代替F和G装置。该装置所用仪器是___,所装试剂是____。
(5)A、D两处加热的先后顺序是_____________,其理由是_______________。
(6)检验制得的产品中是含有硼粉的实验操作是________________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的氯化氢杂质气体 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸 2B+3Cl2
Mn2++Cl2↑+2H2O 除去氯气中的氯化氢杂质气体 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸 2B+3Cl2![]() 2BCl3 吸收未反应完的氯气,防止污染空气 干燥管或U型管 碱石灰 先A处后D处 排尽装置中的空气,避免氧气与硼粉反应生成B2O3 取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉
2BCl3 吸收未反应完的氯气,防止污染空气 干燥管或U型管 碱石灰 先A处后D处 排尽装置中的空气,避免氧气与硼粉反应生成B2O3 取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉
【解析】(1)装置A制取氯气,因此离子反应方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;(2)盐酸易挥发,制取的氯气中含有氯化氢,B装置的作用是除去氯气中的氯化氢杂质气体;如果拆去B装置,可能的后果是硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;(3)D装置中发生反应是硼粉与氯气反应生成氯化硼,反应的化学方程式为2B+3Cl2
Mn2++Cl2↑+2H2O;(2)盐酸易挥发,制取的氯气中含有氯化氢,B装置的作用是除去氯气中的氯化氢杂质气体;如果拆去B装置,可能的后果是硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;(3)D装置中发生反应是硼粉与氯气反应生成氯化硼,反应的化学方程式为2B+3Cl2![]() 2BCl3;(4)G装置装有氢氧化钠溶液,其作用是吸收未反应完的氯气,防止污染空气;为使实验装置简便,可用一个装置代替F和G装置,可防止空气中的水蒸气进入E,又能吸收未反应完的氯气,该装置所用仪器是干燥管或U型管,所装试剂是碱石灰;(5)A、D两处加热的先后顺序是先A处后D处,其理由是排尽装置中的空气,避免氧气与硼粉反应生成B2O3;(6)检验制得的产品中是含有硼粉的实验操作是取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
2BCl3;(4)G装置装有氢氧化钠溶液,其作用是吸收未反应完的氯气,防止污染空气;为使实验装置简便,可用一个装置代替F和G装置,可防止空气中的水蒸气进入E,又能吸收未反应完的氯气,该装置所用仪器是干燥管或U型管,所装试剂是碱石灰;(5)A、D两处加热的先后顺序是先A处后D处,其理由是排尽装置中的空气,避免氧气与硼粉反应生成B2O3;(6)检验制得的产品中是含有硼粉的实验操作是取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
【题型】综合题
【结束】
10
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为原料生产重铬酸钠Na2Cr2O7·2H2O,其流程如下:
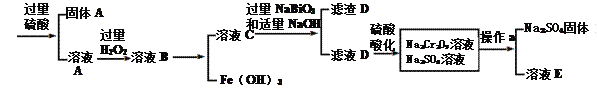
查阅资料得知:
①常温下,NaBiO3难溶于水,有强氧化性。
②常温下,Ksp[Cr(OH)3]=6.4×10-31 Ksp[Fe(OH)3]=4.0×10-38 lg2.5=0.4
③物质溶解度曲线如图所示。
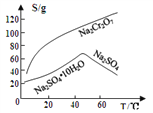
回答下列问题:
(1)Na2Cr2O7·2H2O铬的价态是____,H2O2的电子式为__________。
(2)NaBiO3的作用__________。
(3)滤渣D的成分是__________。
(4)操作a的名称是________、__________。
(5)电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。处理该废水的流程为:

①流程中,Na2S2O3参与反应的的离子方程式__________。
②a=_______,Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1];若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com