
【题目】A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同一周期也不在同一主族,D的氢化物及其最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (选“A”或“D”)。
(2)元素C在元素周期表中的位置是 ,B的最高价氧化物对应的水化物的电子式为 。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为 。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为 。
【答案】(1)D
(2)第三周期ⅢA族![]()
(3)次氯酸钙 ClO-+2H++Cl-=Cl2↑+H2O
【解析】试题分析:A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,则A是氧元素。D的氢化物及其最高价氧化物对应的水化物均为强酸,则D氯元素。B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水,所以B是Na、C是Al。E和其他元素既不在同一周期也不在同一主族,则E是Ca。
(1)水分子间存在氢键,常温下水是液态,氯化氢是气态,则A和D的氢化物中沸点较低的是D。
(2)Al元素的原子序数是13,在元素周期表中的位置是第三周期ⅢA族。B的最高价氧化物对应的水化物是氢氧化钠,含有离子键的离子化合物,电子式为![]() 。
。
(3)O、Cl、Ca可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,则该化合物是次氯酸钙。次氯酸盐具有强氧化性,能与氯离子反应生成氯气,反应的离子方程式为ClO-+2H++Cl-=Cl2↑+H2O。


科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7.下列关于滤液中的离子浓度关系不正确的是( )
A.![]() <1.0×10﹣7mol/L
<1.0×10﹣7mol/L
B.c(Na+)=c(HCO ![]() )+c(CO
)+c(CO ![]() )+c(H2CO3)
)+c(H2CO3)
C.c(H+)+c(NH4+)>c(OH﹣)+c(HCO ![]() )+2 c(CO
)+2 c(CO ![]() )
)
D.c(Cl﹣)>c(HCO ![]() )>c(NH4+)>c(CO
)>c(NH4+)>c(CO ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系错误的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(CH3COO﹣)>c(OH﹣)
B.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO ![]() )+3c(HCO3﹣)+3c(H2CO3)
)+3c(HCO3﹣)+3c(H2CO3)
C.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O ![]() )+c(HC2O
)+c(HC2O ![]() )+c(OH﹣)+c(Cl﹣)=c(Na+)+c(H+)
)+c(OH﹣)+c(Cl﹣)=c(Na+)+c(H+)
D.0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合:c(NH3?H2O)>c(NH ![]() )>c(Cl﹣)>c(OH﹣)
)>c(Cl﹣)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3 NA
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:相关物质的溶度积常数见表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10﹣20 | 2.6×10﹣39 | 1.7×10﹣7 | 1.3×10﹣12 |
现有某酸性CuCl2溶液中含有少量的FeCl2 , 为得到纯净的CuCl22H2O晶体,按如图步骤进行提纯:
(1)最适合作氧化剂X的是(填字母),加入X的目的是 . A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= . 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I﹣发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000molL﹣1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32﹣═S4O62﹣+2I﹣)①可选用作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为 .
③该试样中CuCl22H2O的质量百分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.请填写下列空白.
(1)E元素基态原子的核外电子排布式为 .
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为(填元素符号),其原因为 .
(3)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为;1mol B2A4分子中含molσ键.
(4)已知D、E能形成晶胞如图所示的两种化合物 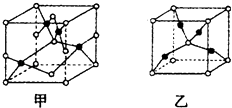 ,化合物的化学式,甲为 , 乙为;高温时,甲易转化为乙的原因为 .
,化合物的化学式,甲为 , 乙为;高温时,甲易转化为乙的原因为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为l∶2,下列有关说法正确的是( )
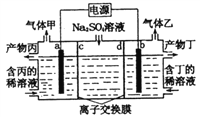
A. a电极反应式为:2H++2e-= H2↑
B. 产物丙为硫酸溶液
C. 离子交换膜d 为阴离子交换膜
D. 每转移0.1mol电子,产生1.12 L的气体乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物理量与其单位匹配正确的是( )
A.质量﹣﹣g
B.反应速率﹣﹣molL﹣1
C.摩尔质量﹣﹣gmol﹣1
D.气体摩尔体积﹣﹣Lmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com