
【题目】斑蝥素具有良好的抗肿瘤活性。下列反应是一个合成斑蝥素的路线:

(1)化合物A中含氧官能团的名称为___、___。
(2)B→C的反应类型是___。
(3)D与乙二醇发生缩聚反应的方程式为:___。
(4)物质X的结构简式为___。
(5)请写出以![]() 为原料制备
为原料制备 的合成路线流程图___(无机试剂可任用,合成路线流程图见本题题干)。
的合成路线流程图___(无机试剂可任用,合成路线流程图见本题题干)。
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列体系中指定微粒或化学键的数目一定为NA的是
A. 46.0 g乙醇与过量冰醋酸在浓硫酸加热条件下反应所得乙酸乙酯分子
B. 36.0 gCaO2与足量水完全反应过程中转移的电子
C. 53.5 g氯化铵固体溶于氨水所得中性溶液中的NH4+
D. 5.0 g乙烷中所含的共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() =2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
=2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
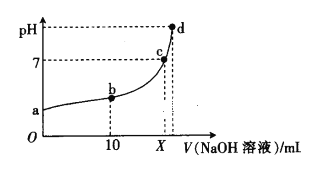
A. X=20
B. a点溶液中c(H+)=2.14×10-3 mol·L-1
C. a、b、c、d四点对应的溶液中水的电离程度逐渐减小
D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年我国女科学家屠呦呦因“发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得有诺贝尔奖“风向标”之誉的拉斯克临床医学奖。青蒿素结构式如图所示。已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”。下列有关青蒿素的说法不正确的是( )

A.青蒿素分子有6个手性碳原子
B.青蒿素的化学式为:C15H22O5
C.青蒿素在一定条件下能与NaOH溶液反应,且有氧化性
D.青蒿素是脂溶性的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气和氯气是重要的工业原料,某兴趣小组设计了相关实验探究它们的某些性质。
实验一:认识喷泉实验的原理,并测定电离平衡常数K(NH3·H2O)。
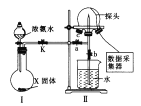
(1)使图中装置Ⅱ产生喷泉的实验操作是_____________________________________。
(2)喷泉实验结束后,发现三颈烧瓶中未充满水(假如装置的气密性良好),原因是______。用___________(填仪器名称)量取25.00 mL喷泉实验后的氨水至锥形瓶中,用0.0500 mol·L-1的盐酸测定氨水的浓度,滴定曲线如图所示。下列关于该滴定实验的说法中正确的是__________(填字母)。
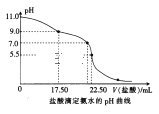
A.应选择甲基橙作为指示剂
B.当pH=7.0时,氨水与盐酸恰好中和
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.当pH=11.0时,K(NH3·H2O)约为2.2×10-5
实验二:拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。
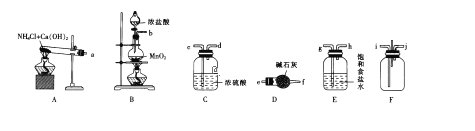
(3)A中所发生反应的化学方程式为__________________________________。
(4)上图中的装置连接顺序为①_________②_________③_________(用大写字母表示)。若按照正确顺序连接实验装置后,则整套实验装置存在的主要缺点是________。
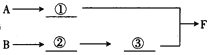
(5)写出F装置中的反应的一种工业用途:___________________________________。
(6)反应完成后,F装置中底部有固体物质生成。请利用该固体物质设计一个实验方案证明NH3·H2O为弱碱(其余实验用品自选):___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,遇水能强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2·2H2O,工艺流程如下:
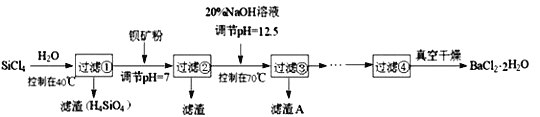
已知:
① 常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4;
② BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244。
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为______________________________________________
(2)用H2还原SiCl4蒸气可制取纯度很高的硅,当反应中有1 mol电子转移时吸收59 kJ热量,则该反应的热化学方程式为__________________________________________________________
(3)加钡矿粉并调节pH=7的目的是①______________________,②______________________
(4)过滤②后的滤液中Fe3+浓度为_______________(滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)。
(5)生成滤渣A的离子方程式________________________________________
(6)BaCl2滤液经___________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是

A. 气体A是NO2
B. X溶液中肯定存在Fe2+、Al3+、NH4+、SO42-
C. 溶液E和气体F不能发生化学反应
D. X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅文献:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价氮的化合物。
Ⅱ.FeSO4 + NO![]() Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被酸性KMnO4溶液氧化吸收。
甲按照如图所示的实验装置进行实验:
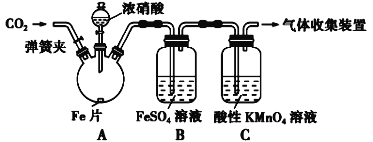
实验操作和现象记录如表所示:
实验操作 | 实验现象 |
打开弹簧夹,通入一段时间CO2,关闭弹簧夹 | |
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞 | 无明显现象 |
加热烧瓶,反应开始后停止加热 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余 |
请回答下列问题:
① 加热前,向烧瓶中滴入浓硝酸没有明显现象的原因是________________________________
② 检验是否生成-3价氮的化合物,应进行的实验操作是________________________________
③ 甲取少量B中溶液,加热,实验现象是____________________________________________,请用化学平衡原理解释原因________________________________________________________,甲依据该现象得出结论:铁与硝酸反应有NO生成。
④乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是____________________________,证明有NO生成的实验现象是________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数10亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:

用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com