
【题目】数10亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:

用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
【答案】H2O、Ne、CH4、NH3 CH4、CO2 NH3、H2O H2O 液态水中水分子间存在氢键,使分子作用力增大,沸点升高 CH4 正四面体 NH3 氢键 N2 不相同 配位键
【解析】
(1)含10电子的分子有CH4、NH3、H2O、Ne等;
(2)具有对称结构的分子是非极性分子;相同非金属元素间形成非极性键,不同的非金属元素间形成极性键,据此分析。
(3)H2O、NH3可与H+直接形成配位键;
(4)影响分子晶体的沸点主要因素是分子间作用力,除此以外,部分物质还要考虑氢键的影响;
(5)甲烷分子中中心碳原子属于sp3杂化,构型为正四面体;
(6)氨气分子和水分子间形成氢键,导致氨气极易溶于水;
(7)由一氧化碳的结构式可知,碳原子和氧原子之间存在三个共价键,氮气分子中两个氮原子之间也存在三个共价键,结构相似。CO的结构可表示为O![]() C,CO中带箭头的键与其他共价键不同,是配位键。
C,CO中带箭头的键与其他共价键不同,是配位键。
(1)含10电子的分子有CH4、NH3、H2O、Ne等;综上所述,本题答案是:H2O、Ne、CH4、NH3。
(2)具有对称结构的分子是非极性分子,如N2、O2、CH4、CO2,其中由极性键形成的非极性分子只有CH4和CO2,另两个非极性分子是由非极性共价键形成的;综上所述,本题答案是:CH4、CO2。
(3)H2O可与H+直接形成配位键,形成H3O+(水合氢离子),NH3与H+以配位键形式结合成NH4+;综上所述,本题答案是:NH3、H2O。
(4)表中所涉及的物质都是由分子构成的。沸点的高低比较主要看范德华力的强弱,但水分子中除了范德华力外,还有氢键的作用,分子间氢键的存在使水的沸点最高;综上所述,本题答案是: H2O;液态水中水分子间存在氢键,使分子作用力增大,沸点升高。
(5)碳原子最外层有4个电子,在甲烷分子中形成了4个共价键,不存在孤电子对,最外层电子都参加成键,中心原子属于sp3z杂化,构型为正四面体形;综上所述,本题答案是:CH4 ,正四面体。
(6)极易溶于水且水溶液呈碱性的物质只有氨气。它极易溶于水,是因为氨分子与水分子间形成氢键,增大了氨气的溶解性;综上所述,本题答案是:NH3 ,氢键。
(7)由一氧化碳的结构式可知,碳原子和氧原子之间存在三个共价键,氮气分子中两个氮原子之间也存在三个共价键,结构相似。CO分子中的三键是由两个不同的原子形成的,是极性共价键,而N2分子中的三键是由两个相同的氮原子形成的,是非极性共价键。CO中带箭头的键与其他共价键不同,是配位键;综上所述,本题答案是:N2;不相同;配位键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】斑蝥素具有良好的抗肿瘤活性。下列反应是一个合成斑蝥素的路线:

(1)化合物A中含氧官能团的名称为___、___。
(2)B→C的反应类型是___。
(3)D与乙二醇发生缩聚反应的方程式为:___。
(4)物质X的结构简式为___。
(5)请写出以![]() 为原料制备
为原料制备 的合成路线流程图___(无机试剂可任用,合成路线流程图见本题题干)。
的合成路线流程图___(无机试剂可任用,合成路线流程图见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:

请回答:
(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
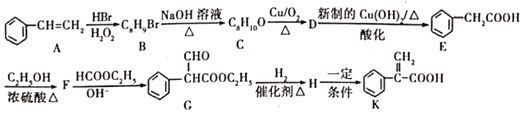
【题目】已知:苯和卤代烃在催化剂的作用下可以生成烷基苯和卤化氢,C是生活中常见的有机物,乙苯能被酸性高锰酸钾溶液氧化为苯甲酸。几种物质之间的转化关系如图所示(生成物中所有无机物均已略去)。

请回答下列问题:
(1)写出物质的结构简式:A____________,C___________,E____________。
(2)在①~⑥6个反应中,属于消去反应的是________(填编号,下同),属于酯化反应的是________。
(3)写出下列反应的化学方程式:
①_____________________________________________________;
②____________________________________________________;
⑥_____________________________________________________。
H→I_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. ![]() 固体含有离子的数目为
固体含有离子的数目为![]()
B. 常温下,![]() 的醋酸溶液中H+数目为
的醋酸溶液中H+数目为![]()
C. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为
组成的碳单质中所含质子数一定为![]()
D. ![]() 与足量
与足量![]() 在一定条件下化合,转移电子数为
在一定条件下化合,转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RLClaisen双酯缩合反应的机理如下:2RCH2COOC2H5![]()
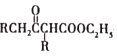 +C2H5OH,利用该反应制备化合物K的一种合成路线如图
+C2H5OH,利用该反应制备化合物K的一种合成路线如图
试回答下列问题:
(1)A与氢气加成所得芳香烃的名称为______;A→B的反应类型是______;D中含氧官能团的名称是______。
(2)C的结构简式为______;F→G的反应除生成G外,另生成的物质为______。
(3)H→K反应的化学方程式为______。
(4)含有苯环结构的B的同分异构体有______种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为______(任写一种即可)。
(5)乙酰乙酸乙酯(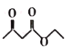 )是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
)是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 粗铜电解精炼时,粗铜、纯铜依次分别作阴极、阳极
B. 5.6 g Fe在足量Cl2中充分燃烧,转移电子的数目为0.2×6.02×1023
C. 室温下,稀释0.1 mol/L NH4Cl溶液,溶液中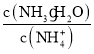 增大
增大
D. 向BaCO3、BaSO4的饱和溶液中加入少量BaCl2,溶液中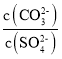 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NVCO{化学式可表示为(NH4)a[(VO)b(CO3)c(OH)d]·10H2O}能用于制取VO2,实验室可由V2O5、N2H4·2HCl、NH4HCO3为原料制备NVCO。
(1)原料NH4HCO3中HCO3-水解的离子方程式为____________。
(2) N2H4·2HCl是N2H4的盐酸盐。已知N2H4在水中的电离方式与NH3相似,25 ℃时,K1=9.55×10-7。该温度下,反应N2H4+H+![]() N2H5+的平衡常数K=________(填数值)。
N2H5+的平衡常数K=________(填数值)。
(3)为确定NVCO的组成,进行如下实验:
①称取2.130 g样品与足量NaOH充分反应,生成NH3 0.224 L(已换算成标准状况下)。
②另取一定量样品在氮气氛中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示(分解过程中各元素的化合价不变)。
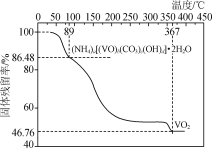
根据以上实验数据计算确定NVCO的化学式(写出计算过程)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为氨气部分用途

下列有关叙述错误的是
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com