
【题目】已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:

请回答:
(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3![]() 2Fe+Al2O3 还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN(或NH4SCN) 溶液变红(或呈现血红色)
2Fe+Al2O3 还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN(或NH4SCN) 溶液变红(或呈现血红色)
【解析】
氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3![]() 2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;
2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;
(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。


科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() =2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
=2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
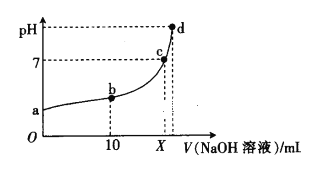
A. X=20
B. a点溶液中c(H+)=2.14×10-3 mol·L-1
C. a、b、c、d四点对应的溶液中水的电离程度逐渐减小
D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是

A. 气体A是NO2
B. X溶液中肯定存在Fe2+、Al3+、NH4+、SO42-
C. 溶液E和气体F不能发生化学反应
D. X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅文献:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价氮的化合物。
Ⅱ.FeSO4 + NO![]() Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被酸性KMnO4溶液氧化吸收。
甲按照如图所示的实验装置进行实验:
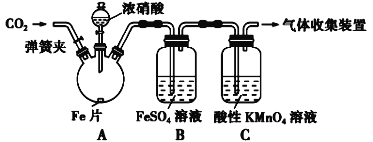
实验操作和现象记录如表所示:
实验操作 | 实验现象 |
打开弹簧夹,通入一段时间CO2,关闭弹簧夹 | |
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞 | 无明显现象 |
加热烧瓶,反应开始后停止加热 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余 |
请回答下列问题:
① 加热前,向烧瓶中滴入浓硝酸没有明显现象的原因是________________________________
② 检验是否生成-3价氮的化合物,应进行的实验操作是________________________________
③ 甲取少量B中溶液,加热,实验现象是____________________________________________,请用化学平衡原理解释原因________________________________________________________,甲依据该现象得出结论:铁与硝酸反应有NO生成。
④乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是____________________________,证明有NO生成的实验现象是________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验过程,请回答:
(1)在常温下,将氯气通入氢氧化钠溶液中,所发生反应的离子方程式为:__;所得溶液具有漂白性,其有效成分的名称为__。
(2)将上述呈碱性的溶液与FeCl3溶液混合,可制得一种新型绿色消毒剂——高铁酸钠(Na2FeO4),反应如下:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O则该反应中的氧化产物是__(填离子符号),当反应中转移电子的数目是0.3NA时,所消耗的氧化剂的物质的量为__。
(3)证实最终所得溶液中含有Na+的操作是:进行焰色实验时,火焰呈现__色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们运用元素周期律和元素周期表,可以系统研究元素的性质。试回答:
(1)碱金属元素中,锂原子的结构示意图为__、其中6Li、7Li互为__,用电子式表示Li2O的形成过程___。
(2)金属钾19K位于元素周期表中的第__周期、第__族;钾的氧化物有多种,其中过氧化钾(K2O2)和超氧化钾(KO2)常作供氧剂,写出过氧化钾与CO2反应的化学方程式:___;超氧化钾与水反应如下,请配平该反应的化学方程式:
_KO2+_H2O=_KOH+_O2↑+_H2O2
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为__、可作半导体材料的元素是__(填名称),当反应H2+Cl2![]() 2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1。
2NH3(g) ΔH=-92.4kJ·mol-1。
①将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1mol,H2为0.4mol,NH3为0.1mol。该条件下H2的转化率为__。此温度下该反应的平衡常数K=___。
②欲提高H2的转化率,下列措施可行的是___。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g) ΔH<0体系中,各成分物质的量随时间的变化如图所示。
2NO2(g) ΔH<0体系中,各成分物质的量随时间的变化如图所示。

①用O2表示0~2s内该反应的平均速率v=___。
②能说明该反应已经达到平衡状态的是___。
a.容器内压强保持不变
b.2v(NO2)=v(O2)
c.v逆(NO)=2v正(O2)
d.容器内物质的密度保持不变
③能使该反应的反应速率增大,且平衡向正反应方向移动的是__。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.将容器的体积缩小至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数10亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:

用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉酸甲酯的一种合成路线如下:
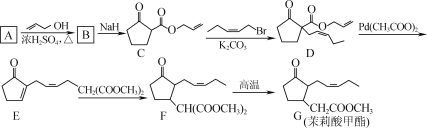
(1) C中含氧官能团名称为________。
(2) D→E的反应类型为________。
(3) 已知A、B的分子式依次为C6H10O4、C12H18O4,A中不含甲基,写出B的结构简式:________。
(4) D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①分子中含有苯环,能与FeCl3溶液发生显色反应;
②碱性条件水解生成两种产物,酸化后两种分子中均只有3种不同化学环境的氢。
(5) 写出以 和CH2(COOCH3)2为原料制备
和CH2(COOCH3)2为原料制备 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com