
����Ŀ�������Ǵ����к����������壬�о������仯�������������Ҫ�����塣
��1���ϳɰ���ԭ��ΪN2(g)��3H2(g)![]() 2NH3(g) ��H=-92.4kJ��mol-1��
2NH3(g) ��H=-92.4kJ��mol-1��
�ٽ�һ������N2(g)��H2(g)����2L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬ƽ��ʱ���N2Ϊ0.1mol��H2Ϊ0.4mol��NH3Ϊ0.1mol����������H2��ת����Ϊ__�����¶��¸÷�Ӧ��ƽ�ⳣ��K=___��
�������H2��ת���ʣ����д�ʩ���е���___��
a.�������а�ԭ�����ٳ���ԭ����
b.���������ٳ����������
c.�ı䷴Ӧ�Ĵ���
d.Һ��������������
��2����2L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g)![]() 2NO2(g) ��H��0��ϵ�У����ɷ����ʵ�����ʱ��ı仯��ͼ��ʾ��
2NO2(g) ��H��0��ϵ�У����ɷ����ʵ�����ʱ��ı仯��ͼ��ʾ��

����O2��ʾ0��2s�ڸ÷�Ӧ��ƽ������v=___��
����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����___��
a.������ѹǿ���ֲ���
b.2v(NO2)=v(O2)
c.v��(NO)=2v��(O2)
d.���������ʵ��ܶȱ��ֲ���
����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����__��
a.��ʱ�����NO2����
b.�ʵ������¶�
c.����O2��Ũ��
d.���������������1L
���𰸡�27.3% 6.25��L��mol��1��2 ad 0.0015mol��L��1min��1 ac cd
��������
��1���ϳɰ���ԭ��ΪN2(g)��3H2(g)![]() 2NH3(g) ��H=-92.4kJ��mol-1��
2NH3(g) ��H=-92.4kJ��mol-1��
�ٸ��ݻ�ѧ����ʽ������ʽ��ʽ���㣺
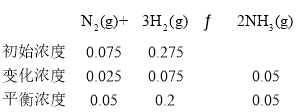
��������H2��ת����=![]() ��100%��27.3%��
��100%��27.3%��
ƽ�ⳣ��K=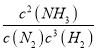 =
=![]() =6.25��L��mol��1��2
=6.25��L��mol��1��2
�ʴ�Ϊ��27.3%��6.25��L��mol��1��2��
�ڸ��ݻ�ѧƽ�⣺N2��g��+3H2��g��![]() 2NH3��g������Ӧ�����������С�ķ��ȷ�Ӧ������� H2��ת���ʣ�ƽ��������У�
2NH3��g������Ӧ�����������С�ķ��ȷ�Ӧ������� H2��ת���ʣ�ƽ��������У�
a���������а�ԭ�����ٳ���ԭ��������ѹǿ����ƽ�������ƶ���������ת��������a��ȷ��
b�����������ٳ���������壬������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���������ת���ʲ��䣬��b����
c���ı䷴Ӧ�Ĵ�������Ӱ��ƽ����ƶ���������ת���ʲ��䣬��c����
d��Һ����������������ƽ�������ƶ���������ת��������d��ȷ��
��ѡad��
��2������ͼ�����ݿ�֪���ɷ���ʽ2NO��g��+O2��g��![]() 2NO2��g����֪��ƽ��ʱ��c��NO������c��O2������c��NO2��=2��1��2��Ϊ�ݴ��жϱ�ʾ��Ũ�ȱ仯�����ߣ��ֱ�ΪbΪNO��cΪO2��aΪNO2����ͼ�����ݿ�֪2s�ڣ�O2��Ũ�ȱ仯��Ϊ0.005mol��L��1-0.002mol��L��1=0.003mol��L��1������v=
2NO2��g����֪��ƽ��ʱ��c��NO������c��O2������c��NO2��=2��1��2��Ϊ�ݴ��жϱ�ʾ��Ũ�ȱ仯�����ߣ��ֱ�ΪbΪNO��cΪO2��aΪNO2����ͼ�����ݿ�֪2s�ڣ�O2��Ũ�ȱ仯��Ϊ0.005mol��L��1-0.002mol��L��1=0.003mol��L��1������v=![]() ����v��O2��=
����v��O2��=![]() =0.0015mol��L��1min��1��
=0.0015mol��L��1min��1��
�ʴ�Ϊ��0.0015mol��L��1min��1��
����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���ǵ���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣻
a���淴Ӧ������������ʵ�����С��ѹǿ����С��������ѹǿ���ֲ��䣬˵������ƽ�⣬��a��ȷ��
b��δָ���������ʣ�����Ϊͬһ�������ʣ�ʼ�ն�����v��NO2��=2v��O2����ϵ���ʲ���˵������ƽ�⣬��Ϊ��ͬ��������ʣ�����֮�ȵ��ڻ�ѧ������֮�ȣ�˵������ƽ�⣬��b����
c����ͬ���ʱ�ʾ����������֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ����ƽ�⣬��v��(NO)=2v��(O2)��˵������ƽ�⣬��c��ȷ��
d����Ӧ���������������䣬������������䣬�ܶ�ʼ�ղ��䣬�����������ʵ��ܶȱ��ֲ��䣬����˵������ƽ�⣬��d����
��ѡac��
��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����ƽ���ƶ�ԭ�������жϣ�
a����ʱ�����NO2���壬ƽ��������Ӧ�ƶ�������Ӧ���ʽ��ͣ���a����
b���ʵ������¶ȣ���Ӧ��������ƽ�����淴Ӧ�ƶ�����b����
c������O2��Ũ�ȣ���Ӧ��������ƽ��������Ӧ�ƶ�����c��ȷ��
d���������������С��1LŨ������Ӧ��������ƽ��������Ӧ�ƶ�����d��ȷ��
��ѡcd��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ������ɱ��Ч�ʸߡ�������ȾС��ˮ��������ʵ���ҿ�ͨ�����·�Ӧ�Ƶ�
ClO2��2KClO3+H2C2O4+H2SO4![]() 2ClO2��+2CO2��+K2SO4+2H2O������˵����ȷ���ǣ� ��
2ClO2��+2CO2��+K2SO4+2H2O������˵����ȷ���ǣ� ��
A��H2C2O4�ڷ�Ӧ�б���ԭ B��1 molKClO3�μӷ�Ӧ��2mol����ת��
C��ClO2���������� D��KClO3�ڷ�Ӧ�еõ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ(��֪��Ӧ���̷���)���������������ֺ���Ԫ�ص����ӣ�����ClO����ClO3���������ӵ����ʵ���(n)�뷴Ӧʱ��(t)�ı仯ʾ��ͼ��ͼ��ʾ������˵����ȷ����
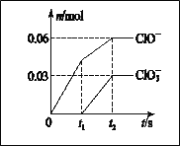
A. ���Լ���Һ��KOH��������4.94 g
B. ��Ӧ��ת�Ƶ��ӵ����ʵ�����0.09 mol
C. ������ClO����ClO3��
D. ClO3���������������¶����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D�������ʾ�������Ԫ�أ��˴�ת����ϵ���£�

��ش�
��1����Ӧ�ٳ�Ϊ���ȷ�Ӧ�������û���Ӧ����д���÷�Ӧ�Ļ�ѧ����ʽ��__������Al��__����
��2����Ӧ�ܵ����ӷ���ʽΪ��__��
��3�������Ƶ�C��Һ��Ӧ����__���Է�ֹ��ת��ΪD������D��Һ�������ӵij����Լ���__���ѧʽ����ʵ������Ϊ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶������ݻ��㶨���ܱ������У����п��淴Ӧ:A(g)+2B(g)![]() C(g)+D(g)���������������������仯ʱ���ܱ����÷�Ӧ�Ѵﵽ�������µ�����ȵ��ǣ� ��
C(g)+D(g)���������������������仯ʱ���ܱ����÷�Ӧ�Ѵﵽ�������µ�����ȵ��ǣ� ��
�������������ѹǿ
�ڻ��������ܶ�
�ۻ�������ƽ����Է�������
��v��(B)=2v��(C)
A.ֻ�Т�B.�ڢ�C.�ڢۢ�D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������±�����ڴ����������¿��������������±���⣬C�������г������л���ұ��ܱ����Ը��������Һ����Ϊ�����ᡣ��������֮���ת����ϵ��ͼ��ʾ(���������������������ȥ)��

��ش��������⣺
(1)д�����ʵĽṹ��ʽ��A____________��C___________��E____________��
(2)�ڢ�����6����Ӧ�У�������ȥ��Ӧ����________(���ţ���ͬ)������������Ӧ����________��
(3)д�����з�Ӧ�Ļ�ѧ����ʽ��
��_____________________________________________________��
��____________________________________________________��
��_____________________________________________________��
H��I_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. ![]() ���庬�����ӵ���ĿΪ
���庬�����ӵ���ĿΪ![]()
B. �����£�![]() �Ĵ�����Һ��H+��ĿΪ
�Ĵ�����Һ��H+��ĿΪ![]()
C. 13g��![]() C��
C��![]() ��ɵ�̼����������������һ��Ϊ
��ɵ�̼����������������һ��Ϊ![]()
D. ![]() ������
������![]() ��һ�������»��ϣ�ת�Ƶ�����Ϊ
��һ�������»��ϣ�ת�Ƶ�����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ��ͭ��⾫��ʱ����ͭ����ͭ���ηֱ�������������
B. 5.6 g Fe������Cl2�г��ȼ�գ�ת�Ƶ��ӵ���ĿΪ0.2��6.02��1023
C. �����£�ϡ��0.1 mol/L NH4Cl��Һ����Һ��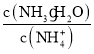 ����
����
D. ��BaCO3��BaSO4�ı�����Һ�м�������BaCl2����Һ��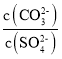 ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)��O2(g)![]() 2SO3(g)����H ����197 kJ��mol��1����25 ��ʱ�����ѹ�ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ�ų�����a1����25 ��ʱ���ڴ˺�ѹ�ܱ�������ֻͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�����a2�������й�ϵ��ȷ����(����)
2SO3(g)����H ����197 kJ��mol��1����25 ��ʱ�����ѹ�ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ�ų�����a1����25 ��ʱ���ڴ˺�ѹ�ܱ�������ֻͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�����a2�������й�ϵ��ȷ����(����)
A. 2a2��a1��197 kJ B. 2a2��a1��197 kJ
C. a2��a1��197 kJ D. 197 kJ��a1��2a2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com