
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、CH4+Cl2
| ||
B、nCH3-CH=CH2
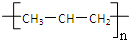 聚合反应 聚合反应 | ||
C、淀粉:(C6H10O5)n+nH2O
| ||
D、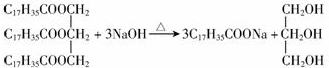 皂化反应 皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
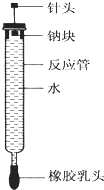 有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
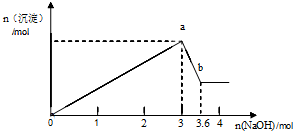
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、Cl-、SO42- |
| B、Cu2+、Ca2+、CO32-、Cl- |
| C、NH4+、Ba2+、NO3-、HCO3- |
| D、K+、Fe3+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com