
【题目】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2),υ逆=υ(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2),υ逆=υ(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A.达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时υ正>υ逆
B.两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C.反应过程中,容器Ⅰ与容器Ⅱ中的总压强之比为3∶1
D.温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
【答案】D
【解析】
A、容器Ⅰ达到平衡时 H2 、 I2 、 HI 的浓度为: 0.07molL1、0.07molL1、0.06mol/L,K=![]() =0.73,达平衡时 , 向容器Ⅰ中同时再通入 0.1molI2 和0.1molHI,Qc=
=0.73,达平衡时 , 向容器Ⅰ中同时再通入 0.1molI2 和0.1molHI,Qc=![]() =2.15>K,则反应逆向进行, υ正<υ逆 ,选项A 错误;
=2.15>K,则反应逆向进行, υ正<υ逆 ,选项A 错误;
B、容器II起始充入0.6mol/LHI等效于起始充入0.3mol/LH2和0.3mol/LI2,容器II起始充入物质的量为容器I的三倍,由于该反应反应前后气体分子数不变,若I、II都为恒容容器,达到平衡时II中各物质的浓度等于I中三倍,II在建立平衡的过程中容积始终不变,所以两容器达平衡时: c(HI, 容器Ⅱ )=3c(HI,容器Ⅰ ) ,选项 B 错误;
C、由于该反应反应前后气体分子数不变,所以建立平衡的过程中,I中压强始终不变,II中体积始终不变,反应过程中,容器Ⅰ与容器Ⅱ中气体的总压强的之比始终为气体物质的量之比,等于 1:3 ,选项C错误;
D、温度一定容器Ⅱ中反应达到平衡状态 ,υ正=υ(H2)消耗=υ(I2)消耗=k正c(H2)·c(I2), 得到 c(H2)c(I2)=![]() ,υ逆=υ(HI)消耗=k逆c2(HI),c2(HI)=
,υ逆=υ(HI)消耗=k逆c2(HI),c2(HI)=![]() , 平衡常数 K=
, 平衡常数 K=![]() ,由于达到平衡时正、逆反应速率相等,所以K=
,由于达到平衡时正、逆反应速率相等,所以K=![]() ,选项D 正确;
,选项D 正确;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于反应N2O4(g)![]() 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上任何一点为对应压强下的平衡点),下列说法正确的是( )
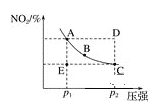
A. A、C两点的正反应速率的关系为A>C
B. A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C. 使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压到p2,再由p2无限缓慢降压至p1
D. 维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y;则x<y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。
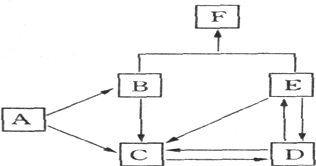
据此,请回答下列问题:
(1)写出以下物质的化学式:A________,D______,F__________。
(2)写出下列变化的化学方程式:
B→C______________________________________________
E→C______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出图1中序号①~④仪器的名称:①__;②__;③__;④__。在仪器①~④中,使用前必须检查是否漏水的有__(填仪器序号)。
(2)图2是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上(密度1.84 g·cm-3,质量分数98%)的部分内容,现用该浓硫酸配制480 mL 1 mol·L﹣1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
a.图3中盛放浓硫酸的试剂瓶标签上应该印有图警示标记中的__(写标记代号A~D)。
b.配制稀硫酸时,除了上述仪器,还缺少的仪器有__、__(写仪器名称)。
c.经计算,配制480 mL 1 mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为__mL(保留一位小数点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是
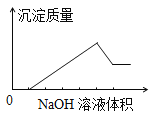
A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:_____FeS2+_____H++_____N![]() =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________(填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
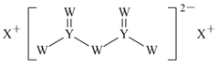
A.熔点:Y单质高于X单质
B.元素非金属性强弱的顺序为W>Y>Z
C.W的简单氢化物稳定性比Y的简单氢化物稳定性低
D.W分别与X、Y、Z形成的二元化合物均只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:C2H5CH=CHCH3+CH2=CH2![]() C2H5CH=CH2+CH2=CHCH3。现以烯烃C5H10为原料,合成有机物M和N,合成路线如图:
C2H5CH=CH2+CH2=CHCH3。现以烯烃C5H10为原料,合成有机物M和N,合成路线如图:
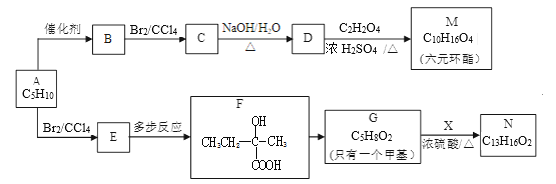
(1)有机物A的结构简式为___。
(2)按系统命名法,B的名称是__。
(3)F→G的反应类型是___。
(4)写出D→M的化学方程式__。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N含有的官能团是(填名称)___。
(6)满足下列条件的X的同分异构体共有__种,写出任意一种的结构简式__。
①遇FeCl3溶液显紫色②苯环上的一氯取代物只有两种
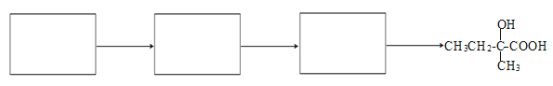
(7)写出E→F合成路线(在指定的3个方框内写有机物,有机物用结构简式表示,箭头上注明试剂和反应条件,若出现步骤合并,要标明反应的先后顺序)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,4条体对角线的1/4处还各有1个碳原子。回答下列问题:

(1)若图中原子1的坐标为![]() ,则原子2的坐标为________。若金刚石的晶胞参数为
,则原子2的坐标为________。若金刚石的晶胞参数为![]() ,则其中碳碳键的键长
,则其中碳碳键的键长![]() ________pm(用含
________pm(用含![]() 的代数式表示)。
的代数式表示)。
(2)面心立方![]() 晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
①S元素及其同周期的相邻元素第一电离能由小到大的顺序是________,二氯化硫(![]() )分子中S原子的杂化类型是________。
)分子中S原子的杂化类型是________。
②写出基态![]() 的电子排布式________;把晶胞示意图中表示
的电子排布式________;把晶胞示意图中表示![]() 的小球全部涂黑_______。
的小球全部涂黑_______。
③锌锰干电池中![]() 可吸收电池反应产生的
可吸收电池反应产生的![]() 生成
生成![]() ,该离子中含有________个
,该离子中含有________个![]() 键。
键。
④若该![]() 晶胞的晶胞参数为
晶胞的晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)
(列出计算式)
(3)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如有文献报道氨晶体中每个氢原子都形成氢键,则每个![]() 与周围________个
与周围________个![]() 通过氢键相结合。
通过氢键相结合。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com