
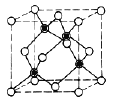
【题目】如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,4条体对角线的1/4处还各有1个碳原子。回答下列问题:

(1)若图中原子1的坐标为![]() ,则原子2的坐标为________。若金刚石的晶胞参数为
,则原子2的坐标为________。若金刚石的晶胞参数为![]() ,则其中碳碳键的键长
,则其中碳碳键的键长![]() ________pm(用含
________pm(用含![]() 的代数式表示)。
的代数式表示)。
(2)面心立方![]() 晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
①S元素及其同周期的相邻元素第一电离能由小到大的顺序是________,二氯化硫(![]() )分子中S原子的杂化类型是________。
)分子中S原子的杂化类型是________。
②写出基态![]() 的电子排布式________;把晶胞示意图中表示
的电子排布式________;把晶胞示意图中表示![]() 的小球全部涂黑_______。
的小球全部涂黑_______。
③锌锰干电池中![]() 可吸收电池反应产生的
可吸收电池反应产生的![]() 生成
生成![]() ,该离子中含有________个
,该离子中含有________个![]() 键。
键。
④若该![]() 晶胞的晶胞参数为
晶胞的晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)
(列出计算式)
(3)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如有文献报道氨晶体中每个氢原子都形成氢键,则每个![]() 与周围________个
与周围________个![]() 通过氢键相结合。
通过氢键相结合。
【答案】![]()
![]()
![]()
![]()
![]()
 或
或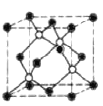 16
16 ![]() 6
6
【解析】
(1)若图中原子1的坐标为(0,0,0),则可建立以原子1为原点的坐标系,根据题干信息可知,原子2位于其中一条对角线上,根据立体几何可知,原子2的坐标为(![]() ,
,![]() ,
,![]() ,),晶胞中C原子形成的碳碳单键的键长刚好为体对角线的
,),晶胞中C原子形成的碳碳单键的键长刚好为体对角线的![]() ,因此,若金刚石的晶胞参数为
,因此,若金刚石的晶胞参数为![]() ,则其中碳碳键的键长为
,则其中碳碳键的键长为![]() pm,故答案为:(
pm,故答案为:(![]() ,
,![]() ,
,![]() ,);
,);![]() ;
;
(2)①与S元素同周期的相邻元素分别为P和Cl,一般情况下,同周期第一电离能逐渐增大,但P的3p轨道为3p3半充满状态,故第一电离能由小到大的为顺序为S<P<Cl,SCl2分子的中心原子的价电子对数为![]() ,则该分子的杂化方式为sp3杂化,故答案为:S<P<Cl;sp3;
,则该分子的杂化方式为sp3杂化,故答案为:S<P<Cl;sp3;
②基态Zn原子为30号元素,核外共有30个电子,而Zn2+失去了两个电子,其核外电子排布式为排布式为[Ar]3d10,ZnS晶胞与金刚石的结构类似,阴、阳离子各占晶胞所含微粒数的一半,则Zn2+可位于晶胞的顶点和面心或直接位于晶胞的体心,故答案为:[Ar]3d10; 或
或 ;
;
③[Zn(NH3)4]2+离子中Zn2+和NH3形成了4个配位键,同时1个NH3中N和H形成3个共价键,则该离子中共含有4+3×4=16个![]() 键,故答案为:16;
键,故答案为:16;
④由②分析可知,1个ZnS晶胞中共由4个ZnS,则晶胞的质量m为![]() ,晶胞的体积V=(a2×10-10)3=a23×10-30cm3,根据密度公式可得该晶体的密度
,晶胞的体积V=(a2×10-10)3=a23×10-30cm3,根据密度公式可得该晶体的密度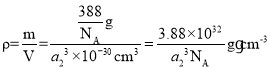 ,故答案为:
,故答案为:![]() ;
;
(3)若氨晶体中每个氢原子都形成氢键,则1个NH3中3个H原子与其他的NH3分子的N原子形成3个氢键,N原子与其他NH3分子的H原子形成3个氢键,则每个NH3与周围6个NH3通过氢键相结合,故答案为:6。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
II.海藻中提取碘的流程如图所示
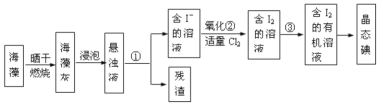
(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有______
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(2)指出提取碘的过程中有关实验操作名称:①________③__________④_________
(3)步骤②反应的离子方程式为___________________,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________
(4)下列关于海藻提取碘的说法,正确的是_________
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛津大学与IBM苏黎世研究中心首次借助原子力显微镜(AFM)对分子甲及反应中间体乙、丙进行高分辨率的探测成像,并利用单原子操纵技术对其进行原子尺度的操作,通过针尖施加电压脉冲逐步切断![]() 基团,最终成功合成了2019年度明星分子丁。下列说法错误的是( )
基团,最终成功合成了2019年度明星分子丁。下列说法错误的是( )
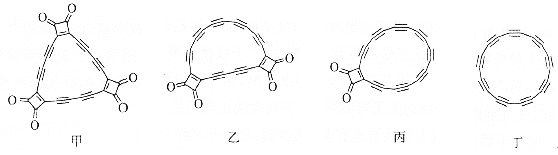
A.甲分子含有6个手性碳原子
B.反应中间体乙、丙都是碳的氧化物
C.丁和石墨互为同素异形体
D.甲生成丁的反应属于分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积和温度不变的密闭容器中充入amolX和足量Y,发生反应:2X(g)+Y(s)![]() Z(g)+W(g),建立平衡后,若再加入bmolX,下列判断不正确的是( )
Z(g)+W(g),建立平衡后,若再加入bmolX,下列判断不正确的是( )
A.平衡正向移动B.X的转化率不变
C.X的转化率减小D.Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁过程中涉及到的主要反应有:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
回答下列问题:
(1)![]() ________
________![]() 。
。
(2)![]() 时,向容积为
时,向容积为![]() 的恒容密闭容器中加入
的恒容密闭容器中加入![]()
![]() 和
和![]()
![]() 发生反应③,5min时达到平衡,平衡时测得混合气体中
发生反应③,5min时达到平衡,平衡时测得混合气体中![]() 的体积分数为80%,则0~5min内反应的平均速率
的体积分数为80%,则0~5min内反应的平均速率![]() ________
________![]() ,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
A.固体的物质的量不再变化
B.体系的压强保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内消耗![]() 和生成
和生成![]() 的物质的量相等
的物质的量相等
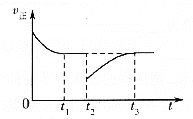
(3)一定条件下进行反应③,正向反应速率与时间的关系如图所示,![]() 时刻改变了一个外界条件,可能是________。
时刻改变了一个外界条件,可能是________。
(4)向密闭容器中加入足量的![]() 、
、![]() 和一定量的
和一定量的![]() 、
、![]() ,在
,在![]() 和
和![]() 下,反应③体系中
下,反应③体系中![]() 和
和![]() 的分压随时间变化的关系如图所示(已知温度:
的分压随时间变化的关系如图所示(已知温度:![]() )
)
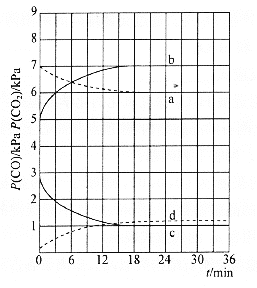
![]() 时,
时,![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时,
时,![]() 随时间变化关系的曲线是________。向
随时间变化关系的曲线是________。向![]() 时已经达到平衡状态的反应③体系中再充入一定量的
时已经达到平衡状态的反应③体系中再充入一定量的![]() ,再次达到平衡时,
,再次达到平衡时,![]() 与
与![]() 的物质的量之比为________。
的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂以含有SO2的尾气、氨气等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
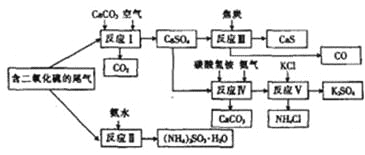
(1)写出反应Ⅲ的化学方程式:___________________________________________。
(2)下列有关说法正确的是_________(填字母)
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:___________。
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为_______。
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4溶液中c(KMnO4) =_________________。
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。
氨气燃料电池的电解质溶液最好选择________(填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是___________,负极的电极反应式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
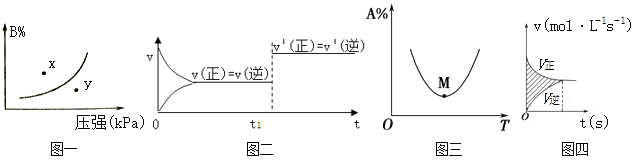
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N具有镇痛、消炎等药理作用,其合成路线如下:
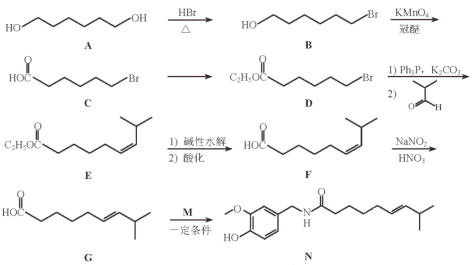
(1)A的系统命名为________________________。
(2)从A→B的反应所得液态有机混合物中提纯B的常用方法为____________。
(3)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(4)C→D的化学方程式为_______________________________________。
(5)M的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
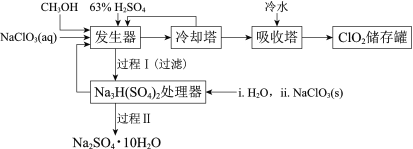
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
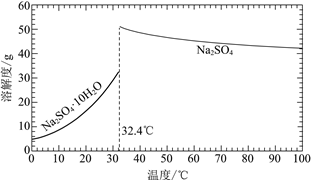
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com