
【题目】牛津大学与IBM苏黎世研究中心首次借助原子力显微镜(AFM)对分子甲及反应中间体乙、丙进行高分辨率的探测成像,并利用单原子操纵技术对其进行原子尺度的操作,通过针尖施加电压脉冲逐步切断![]() 基团,最终成功合成了2019年度明星分子丁。下列说法错误的是( )
基团,最终成功合成了2019年度明星分子丁。下列说法错误的是( )
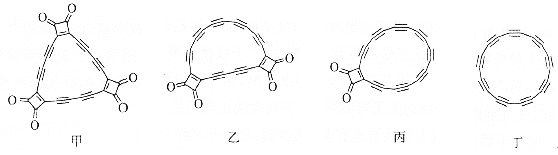
A.甲分子含有6个手性碳原子
B.反应中间体乙、丙都是碳的氧化物
C.丁和石墨互为同素异形体
D.甲生成丁的反应属于分解反应
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6
B. C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同
C. H2O、NH3、CH4分子中的O、N、C原子均采取sp3杂化
D. 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 2 L 0.5 mol·L-1CH3COOH溶液中,CH3COO- 的数目为NA
B. 一定质量的某单质,若含质子数为n NA,则中子数一定小于nNA
C. 标准状况下,22.4LHF含有的共价键数为NA
D. 向FeI2溶液中通入一定量Cl2,当1molFe2+被氧化时,转移的电子数不小于3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)![]() 2NH3(g) △H<0,相关数据如下表所示:
2NH3(g) △H<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | lmolN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/mol/L | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/mol/(L·min) | v甲 | v乙 | v丙 |
下列说法正确的是
A. V甲>V丙 B. K乙>K丙 C. c乙>c甲 D. V甲=V丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在平衡:I2(aq)+I-(aq)![]() I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如图。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如图。下列说法不正确的是
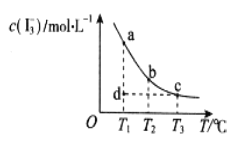
A.反应I2(aq)+I-(aq)![]() I3-(aq)的△H>0
I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态d时,一定有![]() 正>
正>![]() 逆
逆
D.状态a与状态b相比,状态a的c(I2)小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁的用途广泛,可以制备下图所示物质,下列说法错误的是( )
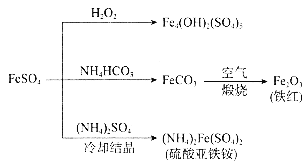
A.![]() 属于碱式盐,可用作净水剂
属于碱式盐,可用作净水剂
B.与足量![]() 反应的离子方程式为:
反应的离子方程式为:![]()
C.可用稀硫酸和![]() 溶液检验铁红中是否含有
溶液检验铁红中是否含有![]()
D.“冷却结晶”后的操作是过滤,“煅烧”操作的主要仪器有酒精灯、蒸发皿、玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,4条体对角线的1/4处还各有1个碳原子。回答下列问题:

(1)若图中原子1的坐标为![]() ,则原子2的坐标为________。若金刚石的晶胞参数为
,则原子2的坐标为________。若金刚石的晶胞参数为![]() ,则其中碳碳键的键长
,则其中碳碳键的键长![]() ________pm(用含
________pm(用含![]() 的代数式表示)。
的代数式表示)。
(2)面心立方![]() 晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
①S元素及其同周期的相邻元素第一电离能由小到大的顺序是________,二氯化硫(![]() )分子中S原子的杂化类型是________。
)分子中S原子的杂化类型是________。
②写出基态![]() 的电子排布式________;把晶胞示意图中表示
的电子排布式________;把晶胞示意图中表示![]() 的小球全部涂黑_______。
的小球全部涂黑_______。
③锌锰干电池中![]() 可吸收电池反应产生的
可吸收电池反应产生的![]() 生成
生成![]() ,该离子中含有________个
,该离子中含有________个![]() 键。
键。
④若该![]() 晶胞的晶胞参数为
晶胞的晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)
(列出计算式)
(3)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如有文献报道氨晶体中每个氢原子都形成氢键,则每个![]() 与周围________个
与周围________个![]() 通过氢键相结合。
通过氢键相结合。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为_______________________________。
(2)与CO互为等电子体的离子为_____(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于______(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 __________。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com