
【题目】硫酸亚铁的用途广泛,可以制备下图所示物质,下列说法错误的是( )
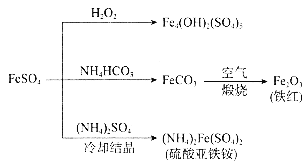
A.![]() 属于碱式盐,可用作净水剂
属于碱式盐,可用作净水剂
B.与足量![]() 反应的离子方程式为:
反应的离子方程式为:![]()
C.可用稀硫酸和![]() 溶液检验铁红中是否含有
溶液检验铁红中是否含有![]()
D.“冷却结晶”后的操作是过滤,“煅烧”操作的主要仪器有酒精灯、蒸发皿、玻璃棒
【答案】BD
【解析】
A.Fe4(OH)2(SO4)5电离后的阴离子为OH-和SO42-,阳离子为Fe3+,属于碱式盐,其中Fe3+可水解产生Fe(OH)3的胶体,吸附水中的杂质,可作净水剂,A选项正确;
B.FeSO4与足量NH4HCO3反应的离子方程式为:Fe2++2HCO3-===FeCO3+CO2↑+H2O,B选项错误;
C.Fe2+能使K3[Fe(CN)6]生成蓝色沉淀,用稀硫酸和K3[Fe(CN)6]溶液检验铁红中是否含有FeCO3,若含有,溶液会生成蓝色沉淀,若不含有,则无明显现象,C选项正确;
D.“冷却结晶”后的操作是过滤,“煅烧”操作的主要仪器有酒精灯、三脚架、坩埚、泥三角、玻璃棒,D选项错误;
答案选BD。


科目:高中化学 来源: 题型:
【题目】钠和钾是极活泼的金属元素,钠和钾及化合物在生产和生活中有广泛的应用。
(1)写出两种可以食用的含钠化合物的化学式:________。将0.01 mol下列物质(①Na2O2;②Na2O;③Na2CO3;④NaCl)分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度由大到小的顺序是(溶液体积变化忽略不计)_______。
(2)由于钾比钠更活泼,制备K2O一般是用单质钾还原对应的过氧化物、硝酸盐或亚硝酸盐,试写出用钾与硝酸钾反应制取K2O的化学方程式(还有一种单质生成):______________________。K2O2也有强氧化性,试写出其与SO2发生反应的化学方程式:_______________________。
(3)某学生用Na2CO3和 KHCO3组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)
实验序号 | ① | ② | ③ | ④ |
盐酸体积/mL | 50 | 50 | 50 | 50 |
固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
根据数据计算所用盐酸的物质的量浓度为__________,原混合物样品中n(Na2CO3)∶n(KHCO3)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从A.甲烷 B.乙酸 C.乙醇 D.蛋白质等四种有机物中,选择合适的物质,将其标号填在横线上。
①蚕丝的主要成分是__________。
②我国“西气东输”的气体主要成分是____________。
③酒驾是指驾驶员呼出的气体中____________含量超标。
④可清除热水瓶内胆水垢[主要成分CaCO3和Mg(OH)2]的是____________。
(2)A、B、C、D、E均为中学常见有机物,其转化关系如下图,回答下列问题:
![]()
①E物质的结构简式为____________,AB的化学方程式为____________。
②实验室利用A和C制取D,反应的化学方程式为_____,收集装置可选用下图______装置(填标号)。
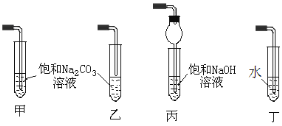
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛津大学与IBM苏黎世研究中心首次借助原子力显微镜(AFM)对分子甲及反应中间体乙、丙进行高分辨率的探测成像,并利用单原子操纵技术对其进行原子尺度的操作,通过针尖施加电压脉冲逐步切断![]() 基团,最终成功合成了2019年度明星分子丁。下列说法错误的是( )
基团,最终成功合成了2019年度明星分子丁。下列说法错误的是( )
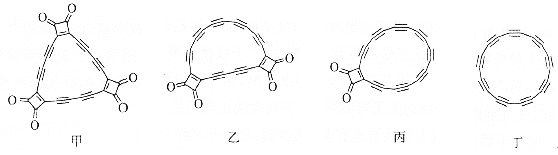
A.甲分子含有6个手性碳原子
B.反应中间体乙、丙都是碳的氧化物
C.丁和石墨互为同素异形体
D.甲生成丁的反应属于分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
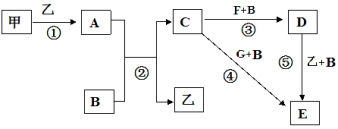
请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 ______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是_____________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积和温度不变的密闭容器中充入amolX和足量Y,发生反应:2X(g)+Y(s)![]() Z(g)+W(g),建立平衡后,若再加入bmolX,下列判断不正确的是( )
Z(g)+W(g),建立平衡后,若再加入bmolX,下列判断不正确的是( )
A.平衡正向移动B.X的转化率不变
C.X的转化率减小D.Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁过程中涉及到的主要反应有:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
回答下列问题:
(1)![]() ________
________![]() 。
。
(2)![]() 时,向容积为
时,向容积为![]() 的恒容密闭容器中加入
的恒容密闭容器中加入![]()
![]() 和
和![]()
![]() 发生反应③,5min时达到平衡,平衡时测得混合气体中
发生反应③,5min时达到平衡,平衡时测得混合气体中![]() 的体积分数为80%,则0~5min内反应的平均速率
的体积分数为80%,则0~5min内反应的平均速率![]() ________
________![]() ,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
A.固体的物质的量不再变化
B.体系的压强保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内消耗![]() 和生成
和生成![]() 的物质的量相等
的物质的量相等
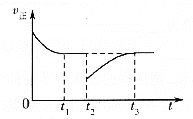
(3)一定条件下进行反应③,正向反应速率与时间的关系如图所示,![]() 时刻改变了一个外界条件,可能是________。
时刻改变了一个外界条件,可能是________。
(4)向密闭容器中加入足量的![]() 、
、![]() 和一定量的
和一定量的![]() 、
、![]() ,在
,在![]() 和
和![]() 下,反应③体系中
下,反应③体系中![]() 和
和![]() 的分压随时间变化的关系如图所示(已知温度:
的分压随时间变化的关系如图所示(已知温度:![]() )
)
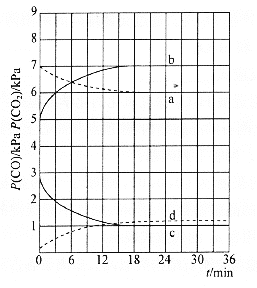
![]() 时,
时,![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时,
时,![]() 随时间变化关系的曲线是________。向
随时间变化关系的曲线是________。向![]() 时已经达到平衡状态的反应③体系中再充入一定量的
时已经达到平衡状态的反应③体系中再充入一定量的![]() ,再次达到平衡时,
,再次达到平衡时,![]() 与
与![]() 的物质的量之比为________。
的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
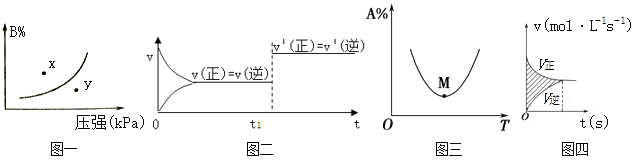
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com