
【题目】在体积和温度不变的密闭容器中充入amolX和足量Y,发生反应:2X(g)+Y(s)![]() Z(g)+W(g),建立平衡后,若再加入bmolX,下列判断不正确的是( )
Z(g)+W(g),建立平衡后,若再加入bmolX,下列判断不正确的是( )
A.平衡正向移动B.X的转化率不变
C.X的转化率减小D.Y的转化率增大
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示:
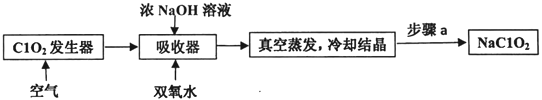
下列说法不正确的是( )
A.步骤a的操作包括过滤、洗涤和干燥
B.通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
C.工业上可将ClO2制成NaClO2固体,便于贮存和运输
D.吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2- -+O2↑+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)![]() 2NH3(g) △H<0,相关数据如下表所示:
2NH3(g) △H<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | lmolN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/mol/L | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/mol/(L·min) | v甲 | v乙 | v丙 |
下列说法正确的是
A. V甲>V丙 B. K乙>K丙 C. c乙>c甲 D. V甲=V丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁的用途广泛,可以制备下图所示物质,下列说法错误的是( )
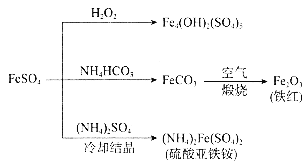
A.![]() 属于碱式盐,可用作净水剂
属于碱式盐,可用作净水剂
B.与足量![]() 反应的离子方程式为:
反应的离子方程式为:![]()
C.可用稀硫酸和![]() 溶液检验铁红中是否含有
溶液检验铁红中是否含有![]()
D.“冷却结晶”后的操作是过滤,“煅烧”操作的主要仪器有酒精灯、蒸发皿、玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某冶金行业产生的废渣(主要含![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)可以制备
等杂质)可以制备![]() ,生产流程如下:
,生产流程如下:
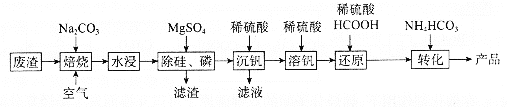
已知:![]() 微溶于水、溶于碱生成
微溶于水、溶于碱生成![]() (加热生成
(加热生成![]() ),具有强氧化性。向
),具有强氧化性。向![]() 溶液中加酸,不同
溶液中加酸,不同![]() 对应的主要存在形式如表:
对应的主要存在形式如表:
|
| 10.6~12 | 约8.4 | 3~8 | 约2 | <1 |
存在形式 |
|
|
|
|
|
|
回答下列问题:
(1)“焙烧”后V元素转化为![]() ,
,![]() 元素转化为________(写化学式)。
元素转化为________(写化学式)。
(2)欲除尽磷元素(即![]() ),最终溶液中
),最终溶液中![]() 的浓度至少为________
的浓度至少为________![]() (已知
(已知![]() )。
)。
(3)“沉钒”过程中,![]() 由8.5到5.0发生反应的离子方程式为________;最终需要控制
由8.5到5.0发生反应的离子方程式为________;最终需要控制![]() 约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
(4)“还原”和“转化”过程中主要反应的离子方程式分为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,4条体对角线的1/4处还各有1个碳原子。回答下列问题:

(1)若图中原子1的坐标为![]() ,则原子2的坐标为________。若金刚石的晶胞参数为
,则原子2的坐标为________。若金刚石的晶胞参数为![]() ,则其中碳碳键的键长
,则其中碳碳键的键长![]() ________pm(用含
________pm(用含![]() 的代数式表示)。
的代数式表示)。
(2)面心立方![]() 晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
①S元素及其同周期的相邻元素第一电离能由小到大的顺序是________,二氯化硫(![]() )分子中S原子的杂化类型是________。
)分子中S原子的杂化类型是________。
②写出基态![]() 的电子排布式________;把晶胞示意图中表示
的电子排布式________;把晶胞示意图中表示![]() 的小球全部涂黑_______。
的小球全部涂黑_______。
③锌锰干电池中![]() 可吸收电池反应产生的
可吸收电池反应产生的![]() 生成
生成![]() ,该离子中含有________个
,该离子中含有________个![]() 键。
键。
④若该![]() 晶胞的晶胞参数为
晶胞的晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)
(列出计算式)
(3)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如有文献报道氨晶体中每个氢原子都形成氢键,则每个![]() 与周围________个
与周围________个![]() 通过氢键相结合。
通过氢键相结合。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A. l00g 9%的葡萄糖水溶液中氧原子数为0.3 NA
B. 标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C. 工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
D. 常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com