
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A. l00g 9%的葡萄糖水溶液中氧原子数为0.3 NA
B. 标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C. 工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
D. 常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA
【答案】C
【解析】
A.溶质葡萄糖和溶剂水中都含有O原子,溶液中所含O原子物质的量n(O)=![]() ×6+
×6+![]() ×1=5.36mol,A错误;
×1=5.36mol,A错误;
B.F2通入足量饱和食盐水,与水发生置换反应产生HF和O2,不能置换出Cl2,B错误;
C.N2是反应物,NH3是生成物,根据方程式可知:每断裂NA个N≡N键,同时断裂6NA个N-H键,表示正逆反应速率相等,表示反应达到平衡状态,C正确;
D.根据电荷守恒可得c(H+)+c(NH4+)=c(OH-)+c(CH3COO-),溶液的pH=7,则c(H+)= c(OH-),因此c(NH4+)=c(CH3COO-),但该盐是弱酸弱碱盐,NH4+、CH3COO- 都水解而消耗,因此二者的物质的量都小于1mol,则它们的数目都小于NA,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
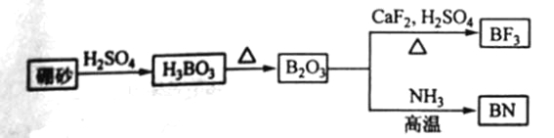
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铁、盐酸、氧气、水、硝酸银溶液五种物质中选出一种或两种作反应物,按下列要求的反应类型各写一个化学方程式。
(1)化合反应_______;
(2)分解反应________;
(3)置换反应________;
(4)复分解反应_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴滴涕(DDT)是20世纪60年代以前广为应用的一种杀虫剂,其结构简式为

DDT因其稳定性、脂溶性、药效普适性等特点而大量使用,最终造成环境污染。下列关于DDT的说法,不正确的是( )
A.DDT也能杀死有益的生物
B.DDT极易溶于水
C.DDT是烃的衍生物
D.DDT不易被生物分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl溶液B. 75 mL 2 mol·L-1NH4Cl溶液
C. 150 mL 2 mol·L-1的KCl溶液D. 100 mL 1.5mol·L-1的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol
H2O(g)+CH3OH(g) △H=-53.7kJ/mol
(1) 308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。


①反应开始至达平衡时,υ(H2)=________;该温度下反应的平衡常数为______mol-2·L2。
②若只改变某一条件,其他条件相同时,曲线变化为II,则改变的条件是____。
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g)![]() H2O(g)+CO(g) △H<0
H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1____T2(填“>”、“<”或“=”);T2时CO2转化为CH3OH的平衡常数K=_______;
②目前,许多国家采用CO2代替CO(以煤和天然气为原料)生产CH3OH,其优点是_________。
(3)用电解法可将CO2转化为多种燃料,原理如图3。铜电极上产生HCOOH的电极反应式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲型H1N1流感病毒曾在全球广泛传播,给人类健康、社会经济带来了巨大的负面影响。我国采取积极应对措施,使病毒得到了有效的控制,从很大程度上减少了损失,在这里,消毒液功不可没。
(1)生产消毒液是将氯气通入NaOH溶液中,该反应的离子方程式为________。
(2)取少量消毒液滴加AgNO3溶液,现象是出现白色沉淀,说明消毒液中有____离子(写离子符号),该反应的的离子方程式为____________。
(3)消毒液稀释后喷洒在空气中,可以生成具有漂白性的物质,该物质为_________;该物质有漂白性是因为它有强的氧化性,但是它也很不稳定,写出它分解反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式__________________________。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是________________________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(3)试管C和D中试剂各为_____________________________。
(4)装置G处发生反应的离子方程式为_______________________________。
(5)用离子方程式表示试剂X的作用_________________________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________________。
②需“密闭保存”的原因____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com