
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
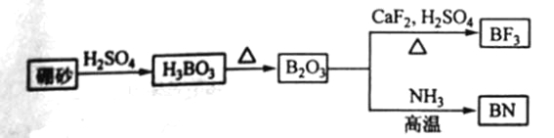
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,下列关于亚硫酸及其钠盐的说法不正确的是
A. Na2SO3溶液和 NaHSO3溶液中含有的离子种类完全相同
B. pH=3的 NaHSO3溶液稀释后,溶液中各离子浓度均减小
C. H2SO3溶液中c(H+)·c(SO32-)/c(H2SO3)减小,可能的措施是加入NaHSO4固体
D. 若0.1 mol/L NaHSO3溶液的pH=2,则0.1 mol/L H2SO3溶液中c(H+)一定小于0.11 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( )
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;1∶6
②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2∶3
③SiO2+3C![]() SiC+2CO↑;1∶2
SiC+2CO↑;1∶2
④3NO2+H2O=2HNO3+NO;2∶1
A.①③B.②③
C.②④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )

A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物,仅含有以下阴、阳离子中的某几种(不考虑水的电离):
阳离子 | K+、Ba2+、Ag+、Mg2+、NH |
阴离子 | Cl-、SO |
为了判断该混合物的组成,现依次进行如下实验,根据实验现象,回答下列问题:
(1)取该固体混合物,加水后固体完全溶解得到无色溶液,用pH试纸测得溶液的pH为12,实验中未嗅到刺激性气味。则混合物组成中肯定不存在的离子是________。
(2)向(1)所得溶液中滴加盐酸,有沉淀生成,同时有无色无味气体逸出。则肯定存在的离子是___,可以排除的离子是________。
(3)取(2)实验后的上层清液,滴加AgNO3溶液,有白色沉淀生成。思考还有没有离子尚待检验?请你对尚待检验的离子提出合理的检验方法(要求写出具体的步骤、现象与结论): ________。如果认为没有尚待检验的离子,此空不填。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为________;水解聚合反应会导致溶液的pH________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×102 mol·L1 K2Cr2O7溶液滴定至终点(滴定过程中![]() 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)在标准状况下,8.96L的甲烷和一氧化碳的混合气体的质量为7.6g,混合气体平均摩尔质量为_____g/mol,混合气体中的甲烷的体积为_____L,一氧化碳的质量为_____g。
(2)某二价金属的氯化物(MCl2)23.75g中含3.01×1个Cl-,则MCl2的物质的量是_____mol,M的相对原子质量为_____。
(3)三种正盐的混合溶液中含有0.2mol NO3-、0.45mol Mg2+、0.4mol Cl-、SO42-,则n(SO42-)为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列方程式。
(1)乙烯通入到溴的四氯化碳溶液中:__________________________________________
(2)乙烷与氯气生成一氯乙烷:________________________________________________
(3)制TNT:________________________________________________________________
(4)由乙炔制聚氯乙烯_____________________________________________
(5)60℃时1,3-丁二烯与溴水发生1,4加成反应________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是_____(填物理变化、化学变化);
(2)从海水中可获得大量的氯化钠,精制盐水时要除去SO42﹣、Mg2+、Ca2+,可依次加入稍过量的溶液是NaOH、_____、_____(写化学式),过滤后,再加入盐酸,蒸发溶液后可得到较纯净的氯化钠。
(3)食盐水能导电,是因为NaCl能电离出Na+和Cl﹣,它们的电子式分别为_____和_____,工业上利用电解饱和食盐水可制得重要化工产品,该反应的化学方程式_____
(4)氢气用途广泛,完全燃烧4g氢气就能烧开一壶水,在标准状况下,这些氢气的体积是_____L,含_____个氢原子。
(5)将制得的氯气通入石灰乳中可以制得漂粉精,其中有效成份为_____(写名称),漂粉精可用于游泳池中水的消毒,原因是(用化学方程式表示):_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com