
【题目】完成下列方程式。
(1)乙烯通入到溴的四氯化碳溶液中:__________________________________________
(2)乙烷与氯气生成一氯乙烷:________________________________________________
(3)制TNT:________________________________________________________________
(4)由乙炔制聚氯乙烯_____________________________________________
(5)60℃时1,3-丁二烯与溴水发生1,4加成反应________________________________
【答案】CH2=CH2+Br2→CH2BrCH2Br CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl 
 CH2=CH-CH=CH2 + Br2
CH2=CH-CH=CH2 + Br2![]() BrCH2CH=CHCH2Br
BrCH2CH=CHCH2Br
【解析】
(1)乙烯能够与溴发生加成反应;
(2)乙烷和氯气光照发生一取代反应;
(3)甲苯能够与浓硝酸、浓硫酸在加热的条件下发生取代反应生成TNT;
(4)乙炔和氯化氢(1:1)发生加成生成1-氯乙烯,1-氯乙烯在一定条件下发生加聚反应生成聚氯乙烯;
(5)60℃时1,3-丁二烯与溴水发生1,4加成反应生成BrCH2CH=CHCH2Br。
(1)乙烯能够与溴发生加成反应生成二溴代烃,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br;综上所述,本题答案是:CH2=CH2+Br2→CH2BrCH2Br。
(2)乙烷属于饱和烃,能够与氯气在光照条件下发生取代反应,反应方程式为:CH3CH3+Cl2![]() CH3CH2Cl+HCl;
CH3CH2Cl+HCl;
(3)甲苯能够与浓硝酸、浓硫酸在加热的条件下发生取代反应生成TNT,反应方程式为: ;综上所述,本题答案是:
;综上所述,本题答案是: 。
。
(4)乙炔和氯化氢(1:1)发生加成生成1-氯乙烯,1-氯乙烯在一定条件下发生加聚反应生成聚氯乙烯,反应方程式为: ;综上所述,本题答案是:
;综上所述,本题答案是: 。
。
(5)60℃时1,3-丁二烯与溴水发生1,4加成反应生成BrCH2CH=CHCH2Br;反应方程式为:CH2=CH-CH=CH2 + Br2![]() BrCH2CH=CHCH2Br;综上所述,本题答案是:CH2=CH-CH=CH2 + Br2
BrCH2CH=CHCH2Br;综上所述,本题答案是:CH2=CH-CH=CH2 + Br2![]() BrCH2CH=CHCH2Br。
BrCH2CH=CHCH2Br。


科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
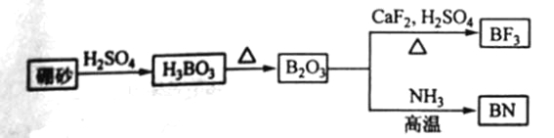
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:

请回答以下问题:
(1)操作a的名称是_____,所用玻璃仪器有_____;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为_____溶液;在III步中,怎样判断试剂乙已加入过量:_____;
(3)写出固体H所含物质的化学式_____;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的化学方程式 ________________;________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯水的叙述,正确的是( )
A.新制氯水中的微粒在只有Cl2和H2O分子
B.氯水放置数天后酸性不变
C.新制氯水可使蓝色石蕊试纸先变红后褪色
D.光照氯水有气泡放出,该气体是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5,依次发生的分解反应为:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
A. 4.25 B. 8.5 C. 17 D. 22.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机物中广泛存在,如图为苯及其几种同分异构体的键线式,下列有关说法中正确的是

A. b、c均与乙烯互为同系物
B. a和d的二氯代物均有3种
C. 4种有机物均能使酸性高锰酸钾溶液褪色
D. a和b中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应原理研究碳、硫及其化合物的性质具有重要意义。
(1)工业上用炭还原辉铜矿(主要成分是Cu2S),可制取金属铜。
已知反应的热化学方程式如下:
C(s)+S2 (g) ═CS2 (g) △H1=150 KJ/mol
Cu2S(s)+H2 (g) ═2Cu(s)+H2S (g) △H2=59.5KJ/mol
2H2S (g) ═2H2 (g) +S2 (g) △H3=170KJ/mol
通过计算,可知用炭还原Cu2S 制取金属铜和CS2(g) 的热化学方程式为___________。
(2)为研究反应2H2S(g)![]() 2H2(g)+S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
2H2(g)+S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
①向三个体积均为1L的恒容密闭容器中分别加入1molH2S,进行H2S分解实验。不同温度下测得H2S 的转化率与时间的关系如图1所示:

T1温度下,0~5min S2(g)的平均反应速率v(S2)=____________mol.L-1.min-1,反应平衡常数K=_____molL-1.温度T1、T2、T3 由高到低的顺序是__________。
②T4温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,则T4_____ T1 (填“<”、“=”或“>”)。
(3)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH 溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42- 的物质的量分数(δ) 与pH的关系如图2所示:
①草酸的电离常数分别为K1与K2,则![]() =_____。
=_____。
②按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是_____(填序号)。
A.该溶液的pH为4.2
B.3c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
C.3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
D.3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4)
(4)含碳的甲醇(CH3OH)的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。
①写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________________。
②常温下,向100 mL0.1mol/L的NaOH溶液中通入一定量的CO2。为探究反应后混合溶液的成分,向其中逐滴加入0.1 mol/L的HCl溶液。溶液产生气体前,消耗V( HCl)=V1;溶液刚好不再产生气体时,消耗V( HCl) =V2。当V1 <V2 <2Vl时,混合溶液中溶质的成分为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 配制FeCl3溶液时,向溶液中加入少量盐酸
B. 实验室用排饱和食盐水的方法收集氯气
C. 往醋酸溶液中加少量碱,有利于CH3COO-的增多
D. H2、I2、HI平衡时的混合气体加压后颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com