
【题目】 (1)在标准状况下,8.96L的甲烷和一氧化碳的混合气体的质量为7.6g,混合气体平均摩尔质量为_____g/mol,混合气体中的甲烷的体积为_____L,一氧化碳的质量为_____g。
(2)某二价金属的氯化物(MCl2)23.75g中含3.01×1个Cl-,则MCl2的物质的量是_____mol,M的相对原子质量为_____。
(3)三种正盐的混合溶液中含有0.2mol NO3-、0.45mol Mg2+、0.4mol Cl-、SO42-,则n(SO42-)为_____mol。
【答案】19g/mol 6.72L 2.8g 0.25 24 0.15mol
【解析】
(1)甲烷和一氧化碳的质量为7.6g,体积为8.96L,在标况下是0.4mol,所以混合气体平均摩尔质量为7.6g÷0.4mol=19g/mol,甲烷的摩尔质量为16 g/mol,一氧化碳的摩尔质量是28 g/mol,根据十字交叉法: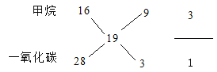 ,甲烷占了3/4,物质的量为0.3mol,体积为6.72L,一氧化碳占了1/4,物质的量为0.1mol,质量为2.8g。故答案为:19,6.72,2.8。
,甲烷占了3/4,物质的量为0.3mol,体积为6.72L,一氧化碳占了1/4,物质的量为0.1mol,质量为2.8g。故答案为:19,6.72,2.8。
(2)3.01×1023个Cl-的物质的量是0.5mol,则MCl2的物质的量是0.25mol,MCl2的摩尔质量是23.75g÷0.25mol=95g/mol,故M的相对原子质量为95-2×35.5=24。故答案为:0.25,24。
(3)根据电荷守恒,n(NO3-)+2n(SO42-)+n(Cl-)+ n(OH-)= 2n(Mg2+)+n(H+),氢离子和氢氧根浓度很小,可以忽略,故n(SO42-)=0.15 mol。


科目:高中化学 来源: 题型:
【题目】一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示,回答下列问题:

(1)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有______任写两种)。
(2)FeSO4溶液与 NH4HCO3溶液反应的离子方程式是________。
(3)TiO2+水解为TiO(OH)2沉淀的离子方程式为__________,需要加入Na2CO3粉末的目的是__________________________________________。
(4)常温下,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,需要控制溶液pH____________时,才能使所得的FeCO3中不含Fe(OH)2。(已知:Ksp[FeCO3] = 3.0×10-11,Ksp[Fe(OH)2] = 1.0×10-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:

(1)A的名称是__________,B中含碳官能团的结构式为__________。
(2)反应③的有机反应类型是__________。
(3)下列说法正确的是(_____)
A. 1mol E与足量的新制氢氧化铜悬浊液反应能生成1molCu2O
B. F能与NaHCO3反应产生CO2
C. 反应①发生的是消去反应
(4)写出E与银铵溶液反应的化学方程式________________________________________。
(5)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有_______种;请写出其中任意两种________________________________________________。
的同分异构体中同时符合下列条件的芳香族化合物共有_______种;请写出其中任意两种________________________________________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
(6)写出反应⑤的化学方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
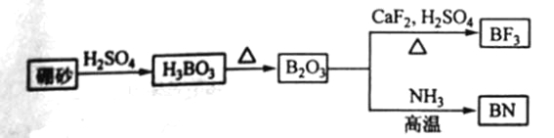
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__(填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________.
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):

①H、O、N三种元素的电负性从大到小的顺序____。
②乙二胺分子中N原子成键时采取的杂化类型是__。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:

请回答以下问题:
(1)操作a的名称是_____,所用玻璃仪器有_____;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为_____溶液;在III步中,怎样判断试剂乙已加入过量:_____;
(3)写出固体H所含物质的化学式_____;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的化学方程式 ________________;________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯水的叙述,正确的是( )
A.新制氯水中的微粒在只有Cl2和H2O分子
B.氯水放置数天后酸性不变
C.新制氯水可使蓝色石蕊试纸先变红后褪色
D.光照氯水有气泡放出,该气体是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机物中广泛存在,如图为苯及其几种同分异构体的键线式,下列有关说法中正确的是

A. b、c均与乙烯互为同系物
B. a和d的二氯代物均有3种
C. 4种有机物均能使酸性高锰酸钾溶液褪色
D. a和b中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1mol·L-1 NaOH溶液中加入0.1mol·L-1的一元酸HA溶液,pH变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. b点所示溶液中c(A-)>c(HA)
D. pH=7时,c(Na+)=c(A-)+c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com