
【题目】25 ℃时,下列关于亚硫酸及其钠盐的说法不正确的是
A. Na2SO3溶液和 NaHSO3溶液中含有的离子种类完全相同
B. pH=3的 NaHSO3溶液稀释后,溶液中各离子浓度均减小
C. H2SO3溶液中c(H+)·c(SO32-)/c(H2SO3)减小,可能的措施是加入NaHSO4固体
D. 若0.1 mol/L NaHSO3溶液的pH=2,则0.1 mol/L H2SO3溶液中c(H+)一定小于0.11 mol/L
【答案】B
【解析】
A.NaHSO3溶液存在HSO3-+H2O ![]() H2SO3+OH-、HSO3-
H2SO3+OH-、HSO3- ![]() H++SO32-,Na2SO3溶液中存在SO32-+H2O
H++SO32-,Na2SO3溶液中存在SO32-+H2O ![]() HSO3-+OH-、HSO3-+H2O
HSO3-+OH-、HSO3-+H2O ![]() H2SO3+OH-,两种溶液中都存在H2O
H2SO3+OH-,两种溶液中都存在H2O![]() H++OH-,存在的粒子有:Na+、H+、OH-、HSO3-、H2O、SO32-、H2SO3,故A正确;B. pH=3的 NaHSO3溶液稀释后,c(H+)减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故B错误;C. H2SO3溶液中加入NaHSO4固体,溶液的酸性增强,c(H+)增大,
H++OH-,存在的粒子有:Na+、H+、OH-、HSO3-、H2O、SO32-、H2SO3,故A正确;B. pH=3的 NaHSO3溶液稀释后,c(H+)减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故B错误;C. H2SO3溶液中加入NaHSO4固体,溶液的酸性增强,c(H+)增大,![]() =
=![]() =
=![]() =
=![]() 减小,故C正确;D. 若0.1 mol/L NaHSO3溶液的pH=2,说明亚硫酸氢钠不能完全电离出氢离子,0.1 mol/L NaHSO3溶液HSO3-电离出的c(H+)=0.01 mol/L,亚硫酸为弱酸,则0.1 mol/L H2SO3溶液中c(HSO3-)<0.1 mol/L ,c(H+)一定小于(0.1+0.01)mol/L,故D正确;故选B。
减小,故C正确;D. 若0.1 mol/L NaHSO3溶液的pH=2,说明亚硫酸氢钠不能完全电离出氢离子,0.1 mol/L NaHSO3溶液HSO3-电离出的c(H+)=0.01 mol/L,亚硫酸为弱酸,则0.1 mol/L H2SO3溶液中c(HSO3-)<0.1 mol/L ,c(H+)一定小于(0.1+0.01)mol/L,故D正确;故选B。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2![]() N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
A. 平均反应速率A>B
B. 平衡时NO2的物质的量B>A
C. 平衡时NO2的转化率A>B
D. 平衡时N2O4的物质的量B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某化学兴趣小组在实验室用如下装置制备氯气:

请回答:
(1)写出A装置中制取氯气的化学方程式____________________。
(2)若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是____________________ (填写数字编号)。
II.某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了方案对废液进行以下三步处理,并回收金属。

请回答:
(1)步骤①中得到的沉淀含有的金属单质有__________。
(2)步骤②是将Fe2+转化为Fe3+,还可以选用的试剂是_____。
A.Fe粉 B.NaOH溶液 C.新制氯水 D.稀硫酸
(3)步骤③中加入氨水生成红褐色沉淀的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在恒容的密闭容器中,发生aA(g) + bB(g) ![]() hH(g),达到平衡后,A、B、H的物质的量分别为a mol、b mol、h mol。已知a + b = 2h,若保持温度不变,将三者的物质的量扩大一倍,则下列判断正确的是
hH(g),达到平衡后,A、B、H的物质的量分别为a mol、b mol、h mol。已知a + b = 2h,若保持温度不变,将三者的物质的量扩大一倍,则下列判断正确的是
A. 达到平衡时,混合气体的密度不变
B. 平衡后b mol/L < c(B) < 2b mol/L
C. 达到平衡时,气体A的质量分数减小
D. 若其他条件不变,将容器改为恒压,则平衡后H的体积分数大于1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S2的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L1Na2S2O3溶液滴定,反应式为I2+2![]() =2I+
=2I+![]() 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示,回答下列问题:

(1)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有______任写两种)。
(2)FeSO4溶液与 NH4HCO3溶液反应的离子方程式是________。
(3)TiO2+水解为TiO(OH)2沉淀的离子方程式为__________,需要加入Na2CO3粉末的目的是__________________________________________。
(4)常温下,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,需要控制溶液pH____________时,才能使所得的FeCO3中不含Fe(OH)2。(已知:Ksp[FeCO3] = 3.0×10-11,Ksp[Fe(OH)2] = 1.0×10-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
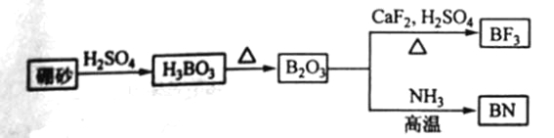
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com