
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol
H2O(g)+CH3OH(g) △H=-53.7kJ/mol
(1) 308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。


①反应开始至达平衡时,υ(H2)=________;该温度下反应的平衡常数为______mol-2·L2。
②若只改变某一条件,其他条件相同时,曲线变化为II,则改变的条件是____。
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g)![]() H2O(g)+CO(g) △H<0
H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1____T2(填“>”、“<”或“=”);T2时CO2转化为CH3OH的平衡常数K=_______;
②目前,许多国家采用CO2代替CO(以煤和天然气为原料)生产CH3OH,其优点是_________。
(3)用电解法可将CO2转化为多种燃料,原理如图3。铜电极上产生HCOOH的电极反应式为_________。

【答案】0.006mol/(L·min) 104 加入催化剂 < 8 CO以煤和天然气为原料,投资较高,且生产成本受煤和天然气价格影响较大,CO2来源广泛,它还是温室气体,可以解决环境污染 CO2+2e-+2H+=HCOOH
【解析】
(1)①开始时混合气体总物质的量=(0.04+0.08)mol=0.12mol,恒温恒容条件下,气体物质的量之比等于压强之比,则平衡时混合气体总物质的量=![]() ×0.12mol=0.08mol,根据方程式知,如果有3mol氢气完全反应,则混合气体物质的量减少2mol,则混合气体减少(0.12-0.08)mol=0.04mol,则消耗n(H2)=
×0.12mol=0.08mol,根据方程式知,如果有3mol氢气完全反应,则混合气体物质的量减少2mol,则混合气体减少(0.12-0.08)mol=0.04mol,则消耗n(H2)=![]() ×0.04mol=0.06mol,反应开始至达平衡时,υ(H2)=
×0.04mol=0.06mol,反应开始至达平衡时,υ(H2)=![]() 计算;
计算;
利用化学平衡常数的含义计算可逆反应CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g)的化学平衡常数;
H2O(g)+CH3OH(g)的化学平衡常数;
②改变条件时只缩短了反应达到平衡时间,但是平衡时压强不变;
(2)①I、II的正反应都是放热反应,升高温度平衡逆向移动,化学平衡常数减小;
反应Ⅰ:CO2(g)+H2(g)![]() H2O(g)+CO(g)△H<0
H2O(g)+CO(g)△H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
将方程式I+II可得相应反应的化学平衡常数K与这两个已知反应的化学平衡常数的关系;
②CO需要煤和天然气制取,且生产成本受原料价格影响;二氧化碳是温室气体,还能解决温室效应;
(3)根据图知,Cu作阴极,阴极上二氧化碳得电子和氢离子反应生成HCOOH。
(1)①开始时混合气体总物质的量=(0.04+0.08)mol=0.12mol,恒温恒容条件下,气体物质的量之比等于压强之比,则平衡时混合气体总物质的量=![]() ×0.12mol=0.08mol,根据方程式知,如果有3mol氢气完全反应,则混合气体物质的量减少2mol,则混合气体减少(0.12-0.08)mol=0.04mol,则消耗n(H2)=
×0.12mol=0.08mol,根据方程式知,如果有3mol氢气完全反应,则混合气体物质的量减少2mol,则混合气体减少(0.12-0.08)mol=0.04mol,则消耗n(H2)=![]() ×0.04mol=0.06mol,反应开始至达平衡时,υ(H2)=
×0.04mol=0.06mol,反应开始至达平衡时,υ(H2)=![]() =0.006mol/(L·min);
=0.006mol/(L·min);
可逆反应CO2(g) + 3H2(g)![]() H2O(g)+CH3OH(g)
H2O(g)+CH3OH(g)
开始(mol)0.04 0.08 0 0
消耗(mol)0.02 0.06 0.02 0.02
平衡(mol)0.02 0.02 0.02 0.02
化学平衡常数K=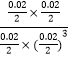 =104L2/mol2;
=104L2/mol2;
②改变条件时只缩短了反应达到平衡时间,但是平衡时压强不变,催化剂只改变化学反应速率不影响平衡移动,所以改变的条件是加入催化剂;
(2)①I、II的正反应都是放热反应,升高温度平衡逆向移动,化学平衡常数减小,根据图知,从左向右化学平衡常数依次减小说明温度依次升高,所以T1<T2;
反应Ⅰ:CO2(g)+H2(g)![]() H2O(g)+CO(g)△H<0
H2O(g)+CO(g)△H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g)△H<0
CH3OH(g)△H<0
将方程式I+II得CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g),化学平衡常数K=K1·K2=4×2=8;
H2O(g)+CH3OH(g),化学平衡常数K=K1·K2=4×2=8;
②CO需要煤和天然气制取,投资较高,且生产成本受煤和天然气价格影响较大;二氧化碳来源广泛,且是温室气体,还能解决温室效应,所以用二氧化碳较好;
(3)根据图知,Cu作阴极,在阴极上CO2得电子和氢离子反应生成HCOOH,电极反应式为CO2+2e-+2H+=HCOOH。


科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为 ___。
(2)化合物(CH3)3N分子中N原子杂化方式为 ___,该物质能溶于水的原因是 ___。
(3)PH3分子的键角小于NH3分子的原因是 ___;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式 为____。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①在一个晶胞中磷原子的配位数为____。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则B-P键长为____pm。
③磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCl3CHO是一种药物合成的中间体,可通过CH3CH2OH + 4Cl2 → CCl3CHO+5HCl进行制备。制备时可能发生的副反应为C2H5OH + HCl→C2H5Cl + H2O、CCl3CHO+HClO—CCl3COOH+HCl。合成该有机物的实验装置示意图(加热装 置未画出)和有关数据如下:


(1)A中恒压漏斗的作用是______;A装置中发生反应的化学方程式为_____。
(2)装置B的作用是____;装置F在吸收气体时,为什么可以防止液体发生倒吸现象______。
(3)装置E中的温度计要控制在70℃,三口烧瓶采用的最佳加热方式是______。如果要在球形冷凝管中注入冷水增加冷凝效果,冷水应该从_____(填“a”或“b”)口通入。实验使用球形冷凝管而不使用直形冷凝管的目的是________。
(4)实验中装置C中的试剂是饱和食盐水,装置中D的试剂是浓H2SO4。如果不使用D装置,产品中会存在较多的杂质_______(填化学式)。除去这些杂质最合适实验方法是______。
(5)利用碘量法可测定产品的纯度,反应原理如下:
CCl3CHO+NaOH→CHC13+HCOONa
HCOONa+I2=HI+NaI+CO2
I2+2Na2S2O3=2NaI+Na2S4O8
称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,调节溶液 为合适的pH后,加入30.00 mL 0.100 mol L-1的碘标准液,用0 100 mol L-1的 Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL,则该次实验所得产品纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A. l00g 9%的葡萄糖水溶液中氧原子数为0.3 NA
B. 标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C. 工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
D. 常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型钮扣电池在现代生活中有着广泛的应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,下列叙述中正确的是
A. 在使用过程中,电池负极区溶液pH增大
B. 外电路中每通过0.2mol电子,正极的质量理论上减小3.2g
C. 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D. 在使用过程中,电流由Ag2O极经外电路流向Zn极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,一些药物引起的不良反应引起了人们的关注。因此在开发新药时如何减少毒副作用是一个很重要的课题。在下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏中毒,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药物合成中“拼合原理”的方法,设计并合成出的解热镇痛药。这三种物质的结构简式如下:

试回答:
(1)为什么阿司匹林会有上述的毒副作用?___________
(2)合成扑炎痛的反应属于有机化学中的哪一类反应?_________
(3)扑炎痛本身并无解热镇痛的功效,但口服进入人体内后会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,试加以解_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是________,原因为______________________;反应速率最小的时间段是________,原因为__________________________。
(2)在2~3 min内,用盐酸的浓度变化表示的反应速率为________。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是________。
A.蒸馏水 B.Na2SO4溶液
C.NaNO3溶液 D.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3的叙述不正确的是( )
2SO3的叙述不正确的是( )
A.该反应是可逆反应
B.反应方程式中“![]() ”表示在相同条件下,反应可以同时向两个方向进行
”表示在相同条件下,反应可以同时向两个方向进行
C.1 mol O2与2 mol SO2混合反应,可生成2 mol SO3
D.在该反应中SO2作还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com