
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
科目:高中化学 来源: 题型:
【题目】20℃时,将等质量的甲、乙两种不与水反应的固体物质(不含结晶水),分别加入到盛有100g 水的烧杯中,充分搅拌后现象如图1,加热到 50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3.则下列说法中错误的是( )
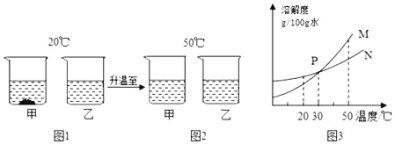
A.图1中乙的溶液可能是不饱和溶液B.图2中两溶液溶质质量分数一定相等
C.图3中 M表示的是甲的溶解度曲线D.图2中两溶液降温至30℃都会析出晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵盐是比较重要的盐类物质,请回答下列问题:
(1)氯化铵溶液可以清洗铁器表面锈迹,写出相关反应的离子方程式:_________________
(2)实验表明氢氧化镁可溶于氯化铵溶液中,两个观点:氯化铵水解显酸性中和OH-,使氢氧化镁沉淀溶解平衡正移;铵根结合OH-,使氢氧化镁沉淀溶解平衡正移。为了探究反应机理,可向溶液中加入_____盐溶液验证。
(3)NH4SCN溶液与AgNO3溶液反应会生成 AgSCN沉淀。已知:室温下,Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)= 2.0×10-12,则AgCl转化为AgSCN的平衡常数K=____________
(4)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为__________________(已知lg1.8 = 0.26)。
③当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O) =_____mol/L (用数字表示)。
(5)为了探究外界条件对氯化铵水解平衡的影响,设计如下实验方案:
实验序号 | c(NH4Cl)/mol.L-1 | 温度/℃ | 待测物理量 | 实验目的 |
Ⅰ | 0.5 | 30 | x | - |
Ⅱ | 1.5 | i | y | 探究浓度对氯化铵水解平衡的影响 |
Ⅲ | 0.5 | 35 | z | ii |
Ⅳ | 2.0 | 40 | m | 探究温度、浓度同时对氯化铵水解平衡的影响 |
限选药品和仪器:恒温水浴、pH计、烧杯、0.1mol.L-1硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液.
①实验中,“待测物理量”是_______________
②i=____________________;ii:___________________________________
③上述表格中,y____(填“>”“<”或“=”)m.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是

A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种物质互为同分异构体的依据是( )
A.二者具有相似的化学性质B.二者分子式相同但分子内碳原子的结合方式不同
C.二者具有相同的空间结构D.二者具有相同的物理性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海水制盐工业中的母液来生产金属镁的一种工艺流程如下下列说法错误的是

A. 上述工艺流程中未涉及置换反应
B. 设计步骤①、②、③的主要目的是富集MgCl2
C. 脱水时在HCl气氛中进行可抑制MgCl2水解
D. 电解得到的炽热镁粉可在氮气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味有机物C和高分子化合物E的合成路线如图1所示。

请回答下列问题:
(1)E的结构简式为________,D分子内含有的官能团是________(填名称)。
(2)写出反应②的反应类型:________。
(3)写出下列反应的化学方程式:
①________________________________________________________________________;
③________________________________________________________________________。
(4)某同学欲用图2装置制备物质C,试管B中装有足量的饱和碳酸钠溶液的目的是:________________________________________;插入试管B的导管接有一个球状物,其作用为________________________________________________________________________;如需将试管B中的物质C分离出来,用到的主要玻璃仪器有:烧杯、________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。

起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1) /℃ | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 _________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________温度。
(4)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(5)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ ) (保留两位小数)。
(6)如果用50 mL0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,则△H会_________(填“偏大”、“偏小”、“无影响”),其原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com