
【题目】钠和钾是极活泼的金属元素,钠和钾及化合物在生产和生活中有广泛的应用。
(1)写出两种可以食用的含钠化合物的化学式:________。将0.01 mol下列物质(①Na2O2;②Na2O;③Na2CO3;④NaCl)分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度由大到小的顺序是(溶液体积变化忽略不计)_______。
(2)由于钾比钠更活泼,制备K2O一般是用单质钾还原对应的过氧化物、硝酸盐或亚硝酸盐,试写出用钾与硝酸钾反应制取K2O的化学方程式(还有一种单质生成):______________________。K2O2也有强氧化性,试写出其与SO2发生反应的化学方程式:_______________________。
(3)某学生用Na2CO3和 KHCO3组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)
实验序号 | ① | ② | ③ | ④ |
盐酸体积/mL | 50 | 50 | 50 | 50 |
固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
根据数据计算所用盐酸的物质的量浓度为__________,原混合物样品中n(Na2CO3)∶n(KHCO3)=_________。
【答案】NaHCO3、NaCl ①=②>③>④ 10K+2KNO3===6K2O+N2↑ K2O2+SO2===K2SO4 2 mol·L-1 1∶2
【解析】
(1)根据等物质的量的Na2O2、Na2O、Na2CO3、NaCl溶于水时的反应方程式分析解答;
(2)钾与硝酸钾反应制取K2O,还有一种单质生成,该单质为N2;K2O2也有强氧化性,与SO2发生反应生成硫酸钾,据此书写方程式;
(3)①②数据可知,固体质量扩大2 倍,生成气体的体积也扩大2倍,所以固体完全反应,根据①中固体的质量和气体的量列方程组计算;④组中盐酸完全反应,根据碳酸钠首先转化为碳酸氢钠,然后盐酸与碳酸氢根离子反应生成气体,结合二氧化碳与盐酸的关系计算消耗的盐酸的物质的量和盐酸的浓度。
(1)可以食用的含钠化合物有氯化钠(NaCl)作调味剂,碳酸氢钠(NaHCO3)通常作发酵剂;由①2Na2O2+2H2O=4NaOH+O2↑,②Na2O+H2O=2NaOH溶于水,二者消耗的水的量相同,生成等物质的量的NaOH,故生成的OH-浓度相同,均约为0.2mol/L,故溶液中阴离子浓度①=②;③中碳酸根水解使得阴离子浓度稍大于④,而④中NaCl的浓度为0.1mol/L,则所得溶液中阴离子浓度的大小顺序是①=②>③>④,故答案为:NaCl、NaHCO3;①=②>③>④;
(2)金属钾可以和硝酸钾之间反应生成氧化钾和氮气,反应的方程式为:2KNO3+10K=6K2O+N2↑;K2O2也有强氧化性,与SO2发生反应,+4价的硫被氧化成+6价,生成硫酸钾,反应为:SO2+K2O2═K2SO4,故答案为:2KNO3+10K=6K2O+N2↑;SO2+K2O2═K2SO4;
(3)①②数据可知,固体质量扩大2 倍,生成气体的体积也扩大2倍,所以固体完全反应,设3.06g原混合物样品中 n(Na2CO3)为xmol,n(KHCO3)为ymol,则:x+y=![]() ,106x+100y=3.06,解得:x=0.01、y=0.02,原混合物样品中 n(Na2CO3)∶n(KHCO3)=1∶2,④组固体质量12.24g,n(Na2CO3)为0.04mol,n(KHCO3)为0.08mol,碳酸钠首先转化为碳酸氢钠,消耗盐酸为:0.04mol,而碳酸氢根离子与盐酸反应生成二氧化碳1.344L,二氧化碳的物质的量=
,106x+100y=3.06,解得:x=0.01、y=0.02,原混合物样品中 n(Na2CO3)∶n(KHCO3)=1∶2,④组固体质量12.24g,n(Na2CO3)为0.04mol,n(KHCO3)为0.08mol,碳酸钠首先转化为碳酸氢钠,消耗盐酸为:0.04mol,而碳酸氢根离子与盐酸反应生成二氧化碳1.344L,二氧化碳的物质的量=![]() =0.06mol,消耗盐酸为0.06mol,所以盐酸的物质的量为0.06+0.04=0.1mol,c=
=0.06mol,消耗盐酸为0.06mol,所以盐酸的物质的量为0.06+0.04=0.1mol,c=![]() =2 molL-1;故答案为:2 molL-1;1∶2。
=2 molL-1;故答案为:2 molL-1;1∶2。


科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:
[Zn(CN)4]2-+4HCHO+4H2O==Zn2++4HOCH2CN+4OH-,回答下列问题:
(1)基态Zn2+的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___________,HOCH2CN分子中含有的σ键与π键数目之比为_________。
(3)HCHO分子中碳原子轨道的杂化类型是________,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是_________________________。
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为_________,提供孤电子对的成键原子是________。
(5)Zn与S形成某种化合物的晶胞如图所示。
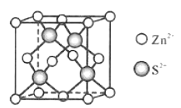
①Zn2+填入S2-组成的___________空隙中;
②已知晶体密度为d g/cm3,该晶胞的边长表达式为______pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6
B. C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同
C. H2O、NH3、CH4分子中的O、N、C原子均采取sp3杂化
D. 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
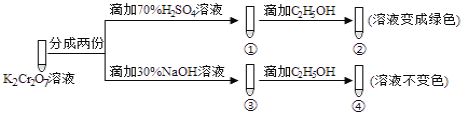
A.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B.②中C2H5OH被Cr2O72-氧化成CH3COOH
C.对比②和④可知K2Cr2O7酸性溶液氧化性比K2CrO4溶液强
D.①中溶液橙色加深,③中溶液变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示:
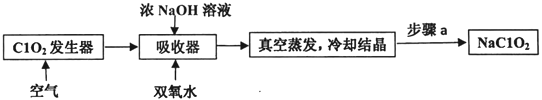
下列说法不正确的是( )
A.步骤a的操作包括过滤、洗涤和干燥
B.通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
C.工业上可将ClO2制成NaClO2固体,便于贮存和运输
D.吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2- -+O2↑+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
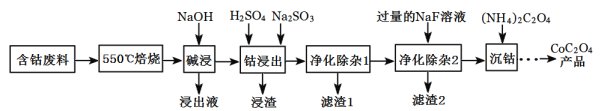
(1)“550℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃加入H2O2溶液,其目的是______。(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是______。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol/L,则滤液中c(Mg2+)为___[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.000g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 2 L 0.5 mol·L-1CH3COOH溶液中,CH3COO- 的数目为NA
B. 一定质量的某单质,若含质子数为n NA,则中子数一定小于nNA
C. 标准状况下,22.4LHF含有的共价键数为NA
D. 向FeI2溶液中通入一定量Cl2,当1molFe2+被氧化时,转移的电子数不小于3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁的用途广泛,可以制备下图所示物质,下列说法错误的是( )
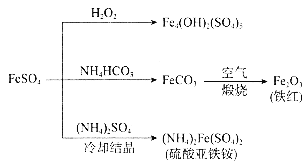
A.![]() 属于碱式盐,可用作净水剂
属于碱式盐,可用作净水剂
B.与足量![]() 反应的离子方程式为:
反应的离子方程式为:![]()
C.可用稀硫酸和![]() 溶液检验铁红中是否含有
溶液检验铁红中是否含有![]()
D.“冷却结晶”后的操作是过滤,“煅烧”操作的主要仪器有酒精灯、蒸发皿、玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com