
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
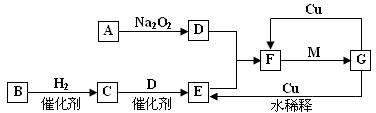
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1 CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1 6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
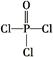 )与季戊四醇(
)与季戊四醇(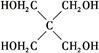 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水有弱碱性,能使湿润的红色石蕊试纸变蓝 |
| B.氨水是弱碱,化学式是 NH3?H2O |
| C.氨水中存在三种分子和四种离子 |
| D.氨很容易液化,液化时放热,液化后得到氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
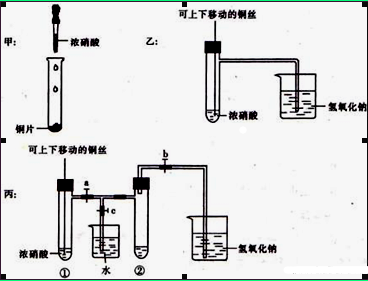
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
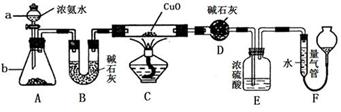
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
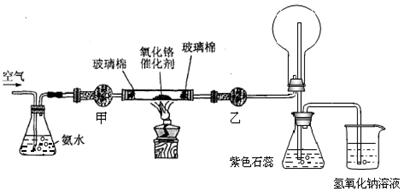
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com