
【题目】水的电离过程为H2O ![]() H+ + OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
H+ + OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低
B.在35℃时,c(H+)>c(OH-)
C.25℃时水的电离程度大于35℃时水的电离程度
D.水的电离是吸热的
科目:高中化学 来源: 题型:
【题目】苯的结构简式可用![]() 来表示,下列关于苯的叙述中正确的是
来表示,下列关于苯的叙述中正确的是
A. 苯主要是以石油为原料而获得的一种重要化工原料
B. 苯中含有碳碳双键,所以苯属于烯烃
C. 苯分子中6个碳碳化学键完全相同
D. 苯可以与溴水、高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )
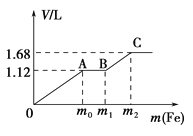
A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 参加反应铁粉的总质量m2=5.6 g
D. 所用混合溶液中c(HNO3)=0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,![]() 有如图转化关系:
有如图转化关系:
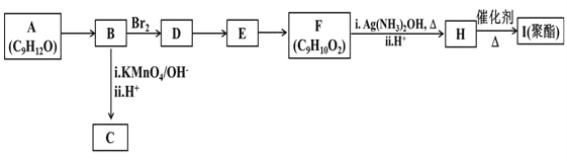
已知:①A的苯环上只有一个支链,支链上有2种不同化学环境的氢原子
②![]() +CO2
+CO2
回答问题:
(1)A的结构简式为_________,A生成B的反应类型为________。
(2)C的化学式为___________。
(3)由D生成E的反应条件为__________。
(4)H中所含官能团的名称为_____________。
(5)I的结构简式为___________。
(6)由E生成F的化学方程为________。
(7)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式________。
①能够发生水解反应和银镜反应;
②属于芳香族化合物且分子中只有一个甲基;
③核磁共振氢谱具有5种不同的吸收峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
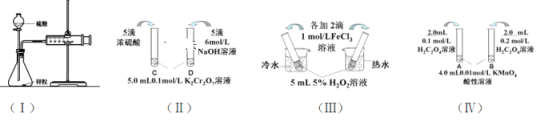
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。①此方法需要控制的变量有(至少写出两项):___。②为了衡量反应的快慢,还可以采用新的测定方法是_____。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
(3)实验(Ⅲ)①实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)①实验目的是_____。②溶液褪色的时间:t(A)________t(B)(填>、<或= )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(![]() )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
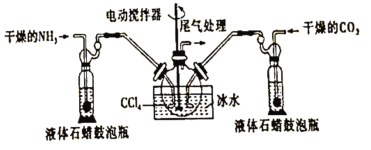
(1)制备氨基甲酸铵的化学方程式为____________
(2)三颈烧瓶用冰水冷却的原因是______________
(3)液体石蜡鼓泡瓶的作用是_______________
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:________(填“是”或“否”),理由:___________
(5)尾气处理装置如图所示,双通玻璃管的作用是_________,浓硫酸的作用是________
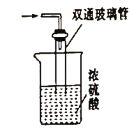
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸在水溶液中,四种微粒的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列说法正确的是
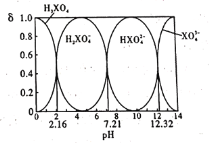
A.H3XO4为三元弱酸,NaH2XO4溶液呈碱性
B.-lgKa3=12.32
C.向0.1 mol/L的Na3XO4溶液中滴加几滴浓KOH溶液,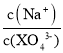 的值变大
的值变大
D.0.1 mol/L的Na2HXO4溶液中,c(Na+)+c(H+)=c(XO43-)+c(HXO42-)+c(H2XO4-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法错误的是( )
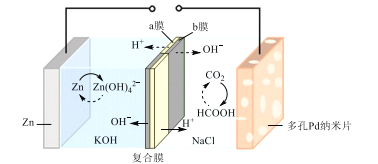
A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol H2O解离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com