
【题目】足量金属钠与下列溶液反应时,既有气体、又有白色沉淀产生的是
A. Al2(SO4)3溶液 B. KCl溶液 C. Ca(HCO3)2溶液 D. CuSO4溶液
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】某研究小组用NaOH溶液吸收尾气中的H2S气体,再将得到的Na2S溶液进行电解制得NaOH溶液,以实现NaOH的循环利用。电解装置如图所示,电极材料均为石墨,ab、cd均为离子交换膜。下列叙述不正确的是
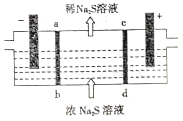
A. ab 表示阳离子交换膜,cd 表示阴离子交换膜
B. 阴极的电极反应式为2H2O-4e-==O2↑+4H+,阴极区溶液pH降低
C. 阳极的电极反应式为S2--2e-==S↓,阳极区有淡黄色沉淀产生
D. 当电路中转移1mol电子时,会有11.2 L (标准状况)的气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同
B. 任何元素的原子都是由核外电子和核内中子、质子构成的
C. 钠原子失去一个电子后变成了氖原子
D. ![]() 、
、![]() 、
、![]() 的质量数相同,所以它们互为同位素
的质量数相同,所以它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定某补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为 ,
步骤③中反应的化学方程式为 。
(2)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量。
(3)若实验中需用98%的浓硫酸(密度为1.84g/mL)配制1 mol/L的稀硫酸480 mL。配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有 ,需用量筒量取该浓硫酸 mL。
(4)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
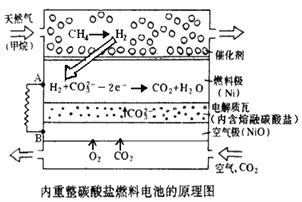
(1)外电路电子流动方向:由_____流向_____(填字母)。
(2)正极发生反应的离子方程式是_______________________________________________.
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e 转移,有_______ g 精铜析出。
(4)25℃时,用石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为____________________; 此时溶液的pH=________(溶液体积变化忽略不计)。
(5)已知常温下Fe(OH)3的溶度积Ksp=1.0×10-38,通常认为残留在溶液中的离子浓度小于 1.0×10-5 mol·L-1时就认为沉淀完全,若使CuCl2溶液中的Fe3+完全沉淀溶液的pH应为_________;加入物质A以调节溶液pH至所需值,A的化学式可以是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )
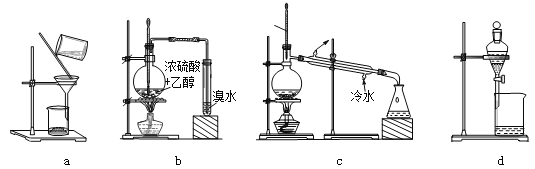
A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)流程甲中加入盐酸后生成Fe3+的离子方程式为____________;固体A_____(填化学式),写出沉淀F转化为氧化铝的化学方程式是_______________。
(2)流程乙中向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是______、________;沉淀Z为_______(填化学式)。由溶液K生成沉淀M的离子方程式是__________。
(3)流程乙中将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________(保留一位小数)。
(4)工业上制取AlCl3:用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com