
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)流程甲中加入盐酸后生成Fe3+的离子方程式为____________;固体A_____(填化学式),写出沉淀F转化为氧化铝的化学方程式是_______________。
(2)流程乙中向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是______、________;沉淀Z为_______(填化学式)。由溶液K生成沉淀M的离子方程式是__________。
(3)流程乙中将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________(保留一位小数)。
(4)工业上制取AlCl3:用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是______。
【答案】Fe2O3+6H+ =2Fe3+ +3H2O SiO2 2Al(OH)3![]() Al2O3+3H2O Al2O3+2OH-+3H2O=2[Al(OH)4]- SiO2+2OH- =SiO32- +H2O H2SiO3 Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+ 65.4% Al2O3+3Cl2+3C
Al2O3+3H2O Al2O3+2OH-+3H2O=2[Al(OH)4]- SiO2+2OH- =SiO32- +H2O H2SiO3 Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+ 65.4% Al2O3+3Cl2+3C![]() 2AlCl3+3CO
2AlCl3+3CO
【解析】
铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。流程甲:铝土矿中加入过量盐酸,氧化铝和氧化铁能够被盐酸溶解,二氧化硅不能,因此固体A为SiO2,滤液B中含有氯化铝、氯化铁等,滤液B中加入过量的烧碱,氯化铝、氯化铁与氢氧化钠反应生成氢氧化铁沉淀和偏铝酸钠溶液,沉淀C为氢氧化铁,滤液D为NaAlO2,滤液D中通入过量的二氧化碳得到的沉淀F为Al(OH)3,滤液E中含有NaHCO3,灼烧氢氧化铝得到Al2O3;
流程乙:铝土矿中加入过量的烧碱溶液,氧化铝和二氧化硅能够被氢氧化钠溶解,氧化铁不能,因此固体X为Fe2O3,滤液Y含有偏铝酸钠、硅酸钠;滤液Y中加入过量的盐酸,得到沉淀Z为硅酸,溶液K中含有氯化铝,溶液K中加入氨水可生成Al(OH)3,灼烧氢氧化铝得到Al2O3,据此分析解答。
(1)流程甲中加入盐酸,氧化铝和氧化铁能够被盐酸溶解,二氧化硅不能,其中生成Fe3+的离子方程式为Fe2O3+6H+=2Fe3++3H2O,得到的固体A为SiO2,根据上述分析,沉淀F为Al(OH)3,氢氧化铝受热分解生成氧化铝,反应的方程式为2Al(OH)3![]() Al2O3+3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;SiO2;2Al(OH)3
Al2O3+3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;SiO2;2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(2)流程乙中铝土矿中加入过量的烧碱溶液,氧化铝和二氧化硅能够被氢氧化钠溶解,氧化铁不能,发生反应的离子方程式有Al2O3+2OH-+3H2O=2[Al(OH)4]-、SiO2+2OH- =SiO32- +H2O;根据上述分析,沉淀Z为硅酸,化学式为H2SiO3;溶液K中含有氯化铝,溶液K中加入氨水可生成Al(OH)3,反应的离子方程式为Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+,故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;SiO2+2OH- =SiO32- +H2O;H2SiO3;Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+;
(3)流程乙中将实验过程中所得固体精确称量,发现所得氢氧化铝固体的质量与原铝土矿质量相等,说明铝土矿中Al2O3的质量分数和氢氧化铝中氧化铝的质量分数是相同的。因为氢氧化铝可以写成Al2O33H2O的形式,所以Al2O3的质量分数是![]() ×100%=65.4%,故答案为:65.4%;
×100%=65.4%,故答案为:65.4%;
(4)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,每消耗0.5mol碳单质,转移1mol电子,则应生成CO,反应的化学方程式为Al2O3+3C+3Cl2![]() 2AlCl3+3CO,故答案为:Al2O3+3C+3Cl2
2AlCl3+3CO,故答案为:Al2O3+3C+3Cl2![]() 2AlCl3+3CO。
2AlCl3+3CO。


科目:高中化学 来源: 题型:
【题目】足量金属钠与下列溶液反应时,既有气体、又有白色沉淀产生的是
A. Al2(SO4)3溶液 B. KCl溶液 C. Ca(HCO3)2溶液 D. CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯/碳高效绿色催化Suzuki 交叉偶联反应是近年来有机合成的热点之一,如反应:
![]()
I II
化合物Ⅱ可由化合物III合成:

(1)化合物Ⅱ的分子式为______________,含有的官能团名称为______________________
(2)化合物Ⅳ的结构简式为_________________________。
(3)化合物Ⅵ与新制Cu(OH)2悬浊液反应的化学方程式为________________________
(4)化合物Ⅴ的一种同分异构体Ⅷ遇FeCl3溶液显紫色,核磁共振氢谱峰面积之比为2:2:2:1,则化合物Ⅷ的结构简式为__________________。
写出化合物Ⅷ与足量NaOH水溶液反应的化学方程式为(注明条件)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,三个干燥烧瓶分别盛①干燥纯净的氨气、②二氧化氮与氧气的混合气(体积比:V(NO2 ):V(O2 )=4:1)、③一半空气的氯化氢,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A. 5:4:5 B. 1:1:1 C. 15: 12: 10 D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器甲、乙中,依次充入氧原子数目相同的O2、O3两种气体,若它们的温度和密度均相同。下列说法正确的是
A. 气体体积:甲>乙 B. 气体的质量:甲<乙
C. 气体的分子数:甲<乙 D. 气体的压强:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下[以F-12 (二氯二氟甲烷)为例]:
CF2Cl2![]() CF2Cl+Cl
CF2Cl+Cl
Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯)
ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率
B. ClO +ClO→ClOOCl的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂
D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含30% SiO2、40. 8% Al2O3和少量Fe2O3等)
干法制取该合金的工艺如下:
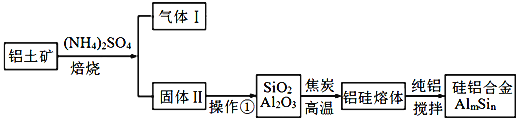
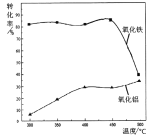
(1)焙烧除铁反应:4(NH4)2SO4+Fe2O3![]() 2NH4Fe(SO4)2+3H2O+6NH3(少部分Al2 O3发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如下图,最适宜焙烧温度为______________。指出气体I的用途 ____________(任写一种)。
2NH4Fe(SO4)2+3H2O+6NH3(少部分Al2 O3发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如下图,最适宜焙烧温度为______________。指出气体I的用途 ____________(任写一种)。
(2)操作①包括:加水溶解、 过滤_______、_________。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为____________________
(3)用焦炭还原SiO2发生反应的化学方程式为_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com