
【题目】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下[以F-12 (二氯二氟甲烷)为例]:
CF2Cl2![]() CF2Cl+Cl
CF2Cl+Cl
Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯)
ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率
B. ClO +ClO→ClOOCl的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂
D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
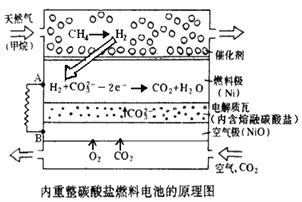
(1)外电路电子流动方向:由_____流向_____(填字母)。
(2)正极发生反应的离子方程式是_______________________________________________.
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e 转移,有_______ g 精铜析出。
(4)25℃时,用石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为____________________; 此时溶液的pH=________(溶液体积变化忽略不计)。
(5)已知常温下Fe(OH)3的溶度积Ksp=1.0×10-38,通常认为残留在溶液中的离子浓度小于 1.0×10-5 mol·L-1时就认为沉淀完全,若使CuCl2溶液中的Fe3+完全沉淀溶液的pH应为_________;加入物质A以调节溶液pH至所需值,A的化学式可以是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家新研制的一种酸性乙醇电池(用磺酸类质子作溶剂),比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=== 2CO2+3H2O,电池构造如下图所示:
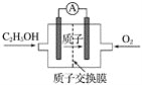
下列关于该电池的说法不正确的是( )
A. 通入乙醇的一极为负极
B. 正极反应式为4H++O2+4e-===2H2O
C. 负极反应式为C2H5OH-12e-+3H2O===2CO2+12H+
D. 随着反应的进行,溶液的酸性保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)流程甲中加入盐酸后生成Fe3+的离子方程式为____________;固体A_____(填化学式),写出沉淀F转化为氧化铝的化学方程式是_______________。
(2)流程乙中向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是______、________;沉淀Z为_______(填化学式)。由溶液K生成沉淀M的离子方程式是__________。
(3)流程乙中将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________(保留一位小数)。
(4)工业上制取AlCl3:用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中含量位于第一、二位的元素之间形成的化合物不具有的性质是( )
A.常温下能与苛性钠反应B.常温下能与水反应
C.常温下能与氢氟酸反应D.高温时能与氧化钙反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备无水乙醇常用蒸馏法,实验步骤如下:
I.回流:在l00mL圆底烧瓶中加入l0g小颗粒状的生石灰和几颗氢氧化钠,慢慢注入50mL工业乙醇,回流1h。
Ⅱ.蒸馏:回流毕,待烧瓶冷却后在烧瓶中加入几粒沸石,改为蒸馏装置,收集78C时的馏分,即为无水乙醇。回流和蒸馏装置如下图(用△表示酒精灯):
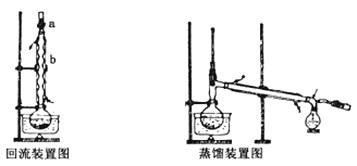
回答下面问题:
(1)装置b的名称是________ 。
(2)简述向烧瓶中加入生石灰的方法_____________
(3)加入NaOH固体是为了除去工业乙醇中少量的醛,发生的关键反应为CH3CHO+CH3CHO![]() CH3CH(OH)CH2CHO,该反应的反应类型为____,回流1h的目的是___ 。
CH3CH(OH)CH2CHO,该反应的反应类型为____,回流1h的目的是___ 。
(4)蒸馏时,先____,后____(①点燃酒精灯②接通冷凝水,填代号),待温度计指示为78℃左右时,尾接管中出现液滴,弃去开始流出的液体,原因是____。
(5)有同学建议改蒸馏为过滤,请回答过滤法不妥的原因 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于明矾可以净水的原因,下列叙述正确的是( )
A.明矾中的硫酸根离子与水中的阳离子结合生成沉淀
B.明矾中的金属铝离子能生成氢氧化铝沉淀
C.明矾溶于水后,生成氢氧化铝胶体,起到净水作用
D.明矾溶于水后,电离产生的金属阳离子吸附能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸共热制取氯气,反应的化学方程式是___________________。
(2)某学习小组利用此原理设计如图所示的装置制取氯气。

①在该实验中,制取氯气的装置是________(填字母)。

②C装置中盛放饱和氯化钠溶液,其作用是____________
③D装置的作用是干燥Cl2,其中盛放的试剂是__________
④写出用NaOH溶液吸收Cl2的化学方程式______________
(3)Cl2和SO2同时通入品红溶液中,漂白效果反而更差。请解释原因(用化学方程式表示):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl- 六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A. 该反应的还原剂是Cl-
B. 消耗1 mol还原剂,转移6 mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 反应后溶液的酸性明显增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com