
【题目】氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸共热制取氯气,反应的化学方程式是___________________。
(2)某学习小组利用此原理设计如图所示的装置制取氯气。

①在该实验中,制取氯气的装置是________(填字母)。

②C装置中盛放饱和氯化钠溶液,其作用是____________
③D装置的作用是干燥Cl2,其中盛放的试剂是__________
④写出用NaOH溶液吸收Cl2的化学方程式______________
(3)Cl2和SO2同时通入品红溶液中,漂白效果反而更差。请解释原因(用化学方程式表示):_____________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O c 除去Cl2中的HCl 浓硫酸 Cl2+2NaOH=NaCl+NaClO+H2O Cl2+SO2+2H2O=2HCl+H2SO4
MnCl2+Cl2↑+2H2O c 除去Cl2中的HCl 浓硫酸 Cl2+2NaOH=NaCl+NaClO+H2O Cl2+SO2+2H2O=2HCl+H2SO4
【解析】
第(2)问,选择反应装置要看物质状态和反应条件;注意氯气中含氯化氢杂质的除杂选用饱和食盐水;第(3)问SO2有还原性,Cl2有氧化性,同时通入品红溶液中,发生氧化还原反应。
(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)①反应物是固液混合的,反应条件是加热,所以该反应需要的装置是固液混合加热型装置,故制取氯气的装置是c;
②HCl易挥发且易溶于水,Cl2在饱和氯化钠溶液中溶解度很小,饱和氯化钠溶液作用是除去Cl2中的HCl;
③D装置的作用是干燥Cl2,其中盛放的试剂是浓硫酸;
④氯气和NaOH溶液反应生成氯化钠和次氯酸钠,故化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O;
(3)Cl2和SO2同时通入品红溶液中,漂白效果反而更差。原因是Cl2和SO2发生氧化还原反应,化学方程式为:Cl2+SO2+2H2O=2HCl+H2SO4。


科目:高中化学 来源: 题型:
【题目】钯/碳高效绿色催化Suzuki 交叉偶联反应是近年来有机合成的热点之一,如反应:
![]()
I II
化合物Ⅱ可由化合物III合成:

(1)化合物Ⅱ的分子式为______________,含有的官能团名称为______________________
(2)化合物Ⅳ的结构简式为_________________________。
(3)化合物Ⅵ与新制Cu(OH)2悬浊液反应的化学方程式为________________________
(4)化合物Ⅴ的一种同分异构体Ⅷ遇FeCl3溶液显紫色,核磁共振氢谱峰面积之比为2:2:2:1,则化合物Ⅷ的结构简式为__________________。
写出化合物Ⅷ与足量NaOH水溶液反应的化学方程式为(注明条件)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下[以F-12 (二氯二氟甲烷)为例]:
CF2Cl2![]() CF2Cl+Cl
CF2Cl+Cl
Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯)
ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率
B. ClO +ClO→ClOOCl的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂
D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来环境问题突出,大气污染更为严重。回答下面问题
(1)下列选项中属于重点城市空气质量日报首要污染物的是_____
A.CO2 B.SO2 C.可吸入颗粒物 D.H2S
(2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是___________
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例)
I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同)
II:CO+Pt(S)=CO(S)
III:NO(S)=N(S)+O(S)
IV:CO(S)+O(S)=CO2+2Pt(S)
V:N(S)+N(S)=N2+2Pt(S)
VI:NO(S)+N(S)=N2O+2Pt(S)
尾气中反应物及生成物浓度随温度的变化关系如下图。
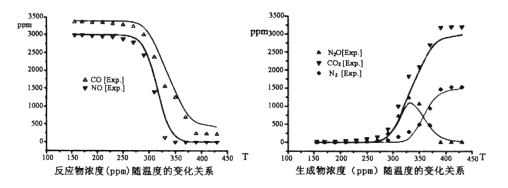
回答下面问题
①汽车尾气消污反应最适宜的反应温度是____
A. 250℃ B.300℃ C.330℃ D.400℃
②330℃以下的低温区发生的主要反应的化学方程式是___________
③低温区N2O选择性高于N2,由此可推断出:V反应的活化能____Ⅵ反应的活化能(填
“<”、“>”或“=”),理由是_______________
④结合反应机理和图像温度位于330℃—400℃时,升高温度,V反应的反应速率_____,(填“增大”、“减小”或“不变”,下同),Ⅳ反应的反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧时焰色反应为黄色,则下列判断正确的是( )
A.该物质一定是金属钠B.该物质一定是氯化钠
C.该物质一定是钠的化合物D.该物质一定含钠元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某同学利用下列实验探究金属铝与铜盐溶液反应:

下列说法正确的是
A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜
B. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
C. 实验2中生成红色物质的离子方程式:Al+Cu2+→Al3++Cu
D. 由上述实验可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol/L的盐酸和硫酸反应,后者更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含30% SiO2、40. 8% Al2O3和少量Fe2O3等)
干法制取该合金的工艺如下:
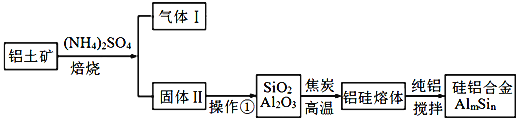
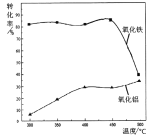
(1)焙烧除铁反应:4(NH4)2SO4+Fe2O3![]() 2NH4Fe(SO4)2+3H2O+6NH3(少部分Al2 O3发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如下图,最适宜焙烧温度为______________。指出气体I的用途 ____________(任写一种)。
2NH4Fe(SO4)2+3H2O+6NH3(少部分Al2 O3发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如下图,最适宜焙烧温度为______________。指出气体I的用途 ____________(任写一种)。
(2)操作①包括:加水溶解、 过滤_______、_________。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为____________________
(3)用焦炭还原SiO2发生反应的化学方程式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
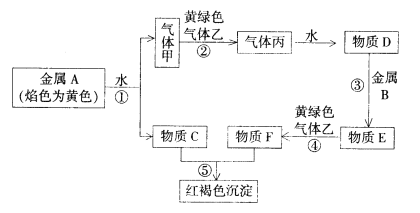
请回答下列问题:
(1)A的化学式为_____________,丙的化学式为_____________;
(2)写出下列反应的离子方程式:
① _________________________________________;
④ _________________________________________;
⑤ _________________________________________。
(3)写出C溶液与Al反应的化学方程式:____________________。
(4)将过氧化钠投入到E溶液中,可以观察到的现象是:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com