
 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:分析 (1)锌锰干电池中,锌作为负极,失去电子;MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气;
(2)②根据NH4Cl易分解的性质选取分离方法;
③Zn2+中不管是先滴加强碱性或弱碱性溶液都能先出现白色沉淀,后沉淀溶解.
解答 解:(1)在锌锰干电池中,活泼金属锌为电池负极,反应式为Zn-2e-=Zn2+,MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气,反应式为2MnO2+H2=Mn2O3+H2O,
故答案为:Zn-2e-=Zn2+;2MnO2+H2=Mn2O3+H2O;
(3)②NH4Cl具有热不稳定性,而且稳定性降低时又能马上化合生成氯化铵,因此可以采用加热方法,
故答案为:加热;
③Zn2+中不管是先滴加强碱性或弱碱性溶液都能先出现白色沉淀,后沉淀溶解,Zn(OH)2也能溶解于氨水,则取少许晶体配成溶液,分为两份,一份逐滴滴加NaOH溶液至过量,另一份逐滴滴加氨水至过量,两溶液中均出现先产生白色沉淀,后沉淀都溶解的现象,说明ZnCl2晶体中含Zn2+;
故答案为:取少许晶体配成溶液,分为两份,一份逐滴滴加NaOH溶液至过量,另一份逐滴滴加氨水至过量,两溶液中均出现先产生白色沉淀,后沉淀都溶解的现象.
点评 本题是以实验为主的综合题,考查物质的提取、分离、检验及电化学知识,题目较为综合,题目难度中等,学习中注意化学实验知识的积累,侧重于考查学生的实验探究能力和分析应用能力.


科目:高中化学 来源: 题型:填空题
 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 用带玻璃塞的磨口瓶盛放NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
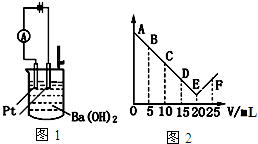
| A. | 此酸的化学式为HNO3 | |
| B. | 处于C点时溶液中导电的阳离子主要是Ba2+、NH4+ | |
| C. | 烧杯中刚加入酸时,观察不到有白色沉淀生成 | |
| D. | 从A→E电流强度I变小的主要原因是生成难溶的盐和难电离的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当V=10时,c(Na+)>c(OH-)>c(HC0${\;}_{3}^{-}$)>c(CH3COO-)>c(H+) | |
| B. | 当 0<V<20 时,c(H+)+c(Na+)=c(HC0${\;}_{3}^{-}$)+c(CH3COO-)+2 c(C032-)+c(OH-) | |
| C. | 当 V=20 时,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 当 V=40 时,c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
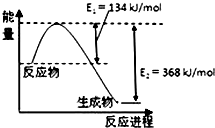 氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
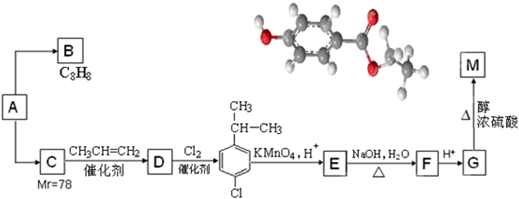
 .
.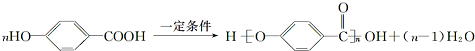 .
.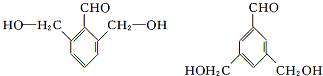 (任意一种).
(任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
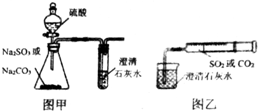 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com