
【题目】在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)4C(g)+5D(g).若经5s后,剩下的A是2.5mol,则A的反应速率是( )
A.0.45 mol/(Ls)
B.0.15 mol/(Ls)
C.0.225 mol/(Ls)
D.0.9 mol/(Ls)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是一种燃料型电池检测仪的工作原理示意图.下列说法不正确的是( ) 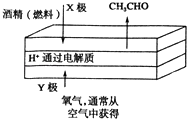
A.该仪器工作时酒精浓度越大,则电流强度越大
B.工作时处电路电子流向为X→Y
C.检测结束后,X极区的pH增大
D.电池总反应为2CH3CH2OH+O2═2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类:主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示).
(1)一定条件下,向1.0mol/LAlCl3溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式: .
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如表:
AlT/(molL﹣1) | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,pH(填“越大”、“越小”或“不变”).
②如将AlT=2.520molL﹣1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: .
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1.当T>80℃时,AlT显著下降的原因是 . 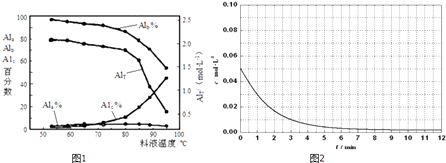
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=a kJmol﹣1
②3AlCl(g)=2Al(l)+AlCl3(g)△H2=b kJmol﹣1
则反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=kJmol﹣1(用含a、b的代数式表示).反应①常压下在1900℃的高温下才能进行,说明△H0(填“>”“=”或“<”).
(4)物质中的铝元素可以通过将铝元素转化成Al3+ , 然后在水溶液中用铝试剂(NH4)3C19H11O3(COO)3(商品名为“阿罗明拿)测定,在弱酸性溶液中,Al3+可以用铝试剂反应,生成玫瑰红色的物质.随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是 .
A.pH计
B.元素分析仪
C.分光光度计
D.原子吸收光谱仪
(5)已知Al3++4X2[( ![]() X2)1.5+],X表示显色剂,
X2)1.5+],X表示显色剂, ![]() X21.5+表示有色物质,通过比色分析得到25℃时Al3+浓度随时间的变化关系如图2所示,请在同一图中绘出
X21.5+表示有色物质,通过比色分析得到25℃时Al3+浓度随时间的变化关系如图2所示,请在同一图中绘出 ![]() X21.5+浓度随时间的变化曲线 .
X21.5+浓度随时间的变化曲线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见物质A、B、C、D、X、Y,存在如下图转化关系(部分物质和条件略去)
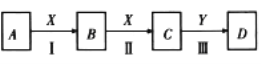
(1)若A为NaOH溶液,X为CO2,D是沉淀,则Y可为________(填序号)。
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
(2)若A为黄铁矿(FeS2),D是H2SO4,则反应Ⅱ的化学方程式为_________________________。
(3)若A为溶于水呈碱性的气体,则A与D反应生成的一种化肥的化学式为_____________,反应Ⅰ的化学方程式为__________________,D的浓溶液与炭反应的化学方程式__________________________。
(4)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,则反应II的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置(夹持装置略)制取和收集纯净、干燥的氨气,并探究氨气的性质。
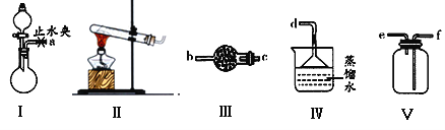
(1)实验室用NH4Cl和Ca(OH)2制取氨气,写出反应的化学方程式是_______________,应选用的发生装置是_____;能否用硝酸铵代替氯化铵___(填“能”或“不能”)。
(2)若利用装置I制取氨气,根据实验要求,
①仪器连接的顺序(用字母编号表示):
a接_____, 接 , 接 。
②装置I应选用的试剂为浓氨水_______ 或 ______(填序号)。
A.氢氯化钠 B.浓硫酸 C.硝酸钾 D.生石灰
③为了得到干燥的氨气,实验室不能用于干燥NH3的试剂是_________。
A.浓硫酸 B.碱石灰 C.NaOH固体
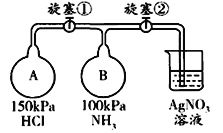
(3)收集一瓶氨气,按下图玻璃装置进行实验。先打开旋塞①,B瓶中产生白色的烟是__________(填化学式);稳定后,关闭旋塞①,再打开旋塞②,B瓶中的现象是__________________________________。
(4)将氨气通入盛有氧化铜粉末的玻璃管中,加热有红色固体单质和无色气体单质生成,证明氨气具有________性,反应的化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( ) 
A.t5时增大了压强
B.t3时降低了温度
C.t2时加入了催化剂
D.t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,D的分子式比C的大16,E是酸,当X无论是强酸或强碱都有如下反应关系:![]()
当X是强酸时, A、B、C、D、E均含同一元素;当X是强碱时, A、B、C、D、E均含另一元素。回答下列问题(用化学式)
(1)A是______,Y是______ ,Z是______
(2)当X是强酸时, E是 ______
(3) 当X是强碱时,E是 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如下:
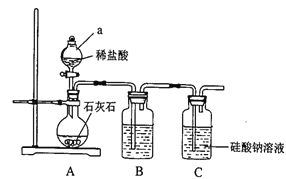
(1)连接好装置后,实验前必须进行的一步操作是_________。仪器a的名称为______。
(2)B装置中盛放的试剂是_________,C中发生反应的化学方程式为_________。
(3)该兴趣小组设计此实验通过_________(填实验现象),可判断碳的非金属性强于硅的非金属性。
(4)该小组的一位同学认为,利用此实验装置及药品,也可以证明非金属性Cl>C>Si,你是否同意该同学的观点?_________(填“同意”或“不同意”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料.
(1)氯气是一种黄绿色气体,化学性质上和氧气有许多相似之处,比如:氯气也能支持燃烧,写出铁丝在氯气中燃烧的方程式: ______ ;氢气在氯气的燃烧观察的现象为: ______
(2)氯气和石灰乳反应可以制得漂白粉,漂白粉暴露在空气中因吸收了空气中的![]() 和
和![]() 而失效,漂白粉失效过程的化学反应方程式为: ______
而失效,漂白粉失效过程的化学反应方程式为: ______
(3)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空![]() 、b、c、d中重合部分代表物质间反应,且氯水足量
、b、c、d中重合部分代表物质间反应,且氯水足量![]() .
.

![]() 过程的反应方程式 ______ , e过程中的化学方程式为 ______ .
过程的反应方程式 ______ , e过程中的化学方程式为 ______ .
![]() 过程所观察到的现象为: ______
过程所观察到的现象为: ______
b过程证明了氯水的存在 ______ 微粒
![]()
![]()
![]()
![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com