
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类:主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示).
(1)一定条件下,向1.0mol/LAlCl3溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式: .
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如表:
AlT/(molL﹣1) | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,pH(填“越大”、“越小”或“不变”).
②如将AlT=2.520molL﹣1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: .
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1.当T>80℃时,AlT显著下降的原因是 . 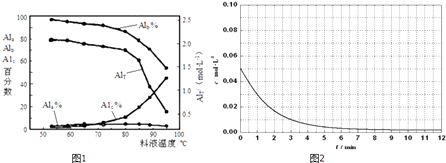
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=a kJmol﹣1
②3AlCl(g)=2Al(l)+AlCl3(g)△H2=b kJmol﹣1
则反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=kJmol﹣1(用含a、b的代数式表示).反应①常压下在1900℃的高温下才能进行,说明△H0(填“>”“=”或“<”).
(4)物质中的铝元素可以通过将铝元素转化成Al3+ , 然后在水溶液中用铝试剂(NH4)3C19H11O3(COO)3(商品名为“阿罗明拿)测定,在弱酸性溶液中,Al3+可以用铝试剂反应,生成玫瑰红色的物质.随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是 .
A.pH计
B.元素分析仪
C.分光光度计
D.原子吸收光谱仪
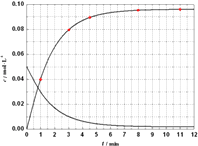
(5)已知Al3++4X2[( ![]() X2)1.5+],X表示显色剂,
X2)1.5+],X表示显色剂, ![]() X21.5+表示有色物质,通过比色分析得到25℃时Al3+浓度随时间的变化关系如图2所示,请在同一图中绘出
X21.5+表示有色物质,通过比色分析得到25℃时Al3+浓度随时间的变化关系如图2所示,请在同一图中绘出 ![]() X21.5+浓度随时间的变化曲线 .
X21.5+浓度随时间的变化曲线 .
【答案】
(1)13Al3++32OH﹣+8H2O=[AlO4Al12(OH)24(H2O)12]7+
(2)越小;Al3++3H2O?Al(OH)3(胶体)+3H+;温度升高,水解程度加大,产生氢氧化铝沉淀
(3)(a+b);>
(4)C
(5)
【解析】解:(1)向1.0molL﹣1 AlCl3溶液中加入0.6molL﹣1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液,根据原子守恒、电荷守恒可得生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式为:13Al3++32OH﹣+8H2O=[AlO4Al12(OH)24(H2O)12]7+ , 所以答案是:13Al3++32OH﹣+8H2O=[AlO4Al12(OH)24(H2O)12]7+;(2)①在一定温度下,AlT越大,Ala%越大,Alc%越小,所以pH越小,所以答案是:越小;②如将AlT=2.520molL﹣1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:Al3++3H2OAl(OH)3(胶体)+3H+ , 所以答案是:Al3++3H2OAl(OH)3(胶体)+3H+;③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图所示,当T>80℃时,AlT显著下降的原因是:温度升高,水解程度加大,产生氢氧化铝沉淀,所以答案是:温度升高,水解程度加大,产生氢氧化铝沉淀;(3)已知:①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=a kJmol﹣1②3AlCl(g)=2Al(l)+AlCl3(g)△H2=b kJmol﹣1根据盖斯定律,①+②可得:Al2O3(s)+3C(s)=2Al(l)+3CO(g),则△H=△H1+△H2=(a+b)kJ/mol;
该反应△S>0,反应①常压下在1900℃的高温下才能进行,△H﹣T△S<0反应自发进行,说明该反应△H>0,所以答案是:(a+b);>;(4)pH计测定溶液pH值,元素分析仪分析组成元素,原子吸收光谱仪分析组成元素,用于比色分析的仪器是分光光度计,故选:C;(5)随反应进行Al3+浓度减小, ![]() X21.5+浓度增大,且△c(
X21.5+浓度增大,且△c( ![]() X21.5+)=2△c(Al3+),
X21.5+)=2△c(Al3+), ![]() X21.5+浓度随时间的变化曲线为:
X21.5+浓度随时间的变化曲线为: 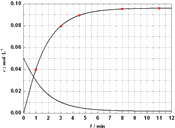 ,所以答案是:
,所以答案是: 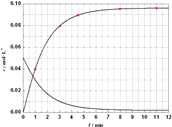 .
.
【考点精析】关于本题考查的化学平衡状态本质及特征,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能得出正确答案.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X,Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) 
A.氯碱工业中,X,Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.若Z是稀硫酸,X为铜,Y为铁,则铁不溶解,该方法为外加电流的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢.当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出过氧化氢的电子式__________.
(2)写出该反应的化学方程式:______________________________.
(3)16g液态肼与足量液态过氧化氢反应生成氮气和水蒸气时,放出的热量为__________kJ.
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试完成下列问题(提示:氢氧化钙的溶解度随温度升高而降低)
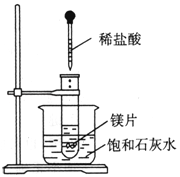
(1)实验中观察到的现象是 ;
(2)产生上述现象的原因是 .
(3)写出有关反应的离子方程式 .
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片的盐酸的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3﹣、SO42﹣、Cl﹣、I﹣、HCO3﹣ , 取该溶液的实验如下:
实验步骤 | 实验现象 |
(1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
(2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
(3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
(4)取(3)中的上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
(5)取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断,下列说法正确的是( )
A.根据实验(1)可以确定溶液中不含有HCO![]() 和I﹣ , 因为这二个离子相对应的酸为弱酸
和I﹣ , 因为这二个离子相对应的酸为弱酸
B.溶液中一定存在的离子是NO![]() 、SO
、SO![]() 、Cl﹣、Mg2+、Al3+;溶液中肯定不存在的离子是:Fe2+、HCO
、Cl﹣、Mg2+、Al3+;溶液中肯定不存在的离子是:Fe2+、HCO![]() 、I﹣、Ba2+
、I﹣、Ba2+
C.为进一步确定其它离子,应该补充焰色反应的实验来检验K+就可以
D.通过实验(1)和(2)就可以确定溶液中一定含有NO![]() ,一定不含有Fe2+、I﹣、HCO
,一定不含有Fe2+、I﹣、HCO![]() ,所以实验步骤(4)的设计是错误的
,所以实验步骤(4)的设计是错误的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.某芳香烃的分子式为C10H14 , 它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种
B.按系统命名法,有机物 ![]() 的命名为2,2,4,4,5﹣五甲基﹣3,3﹣二乙基己烷
的命名为2,2,4,4,5﹣五甲基﹣3,3﹣二乙基己烷
C.甲烷、甲醛、尿素都不存在同分异构体
D.某有机物含有C,H,O,N四种元素,其球棍模型为 ![]() ,该有机物的结构简式为
,该有机物的结构简式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)4C(g)+5D(g).若经5s后,剩下的A是2.5mol,则A的反应速率是( )
A.0.45 mol/(Ls)
B.0.15 mol/(Ls)
C.0.225 mol/(Ls)
D.0.9 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于用比色法测定自制硫酸亚铁铵的纯度的说法正确的是( )
A.配制标准色阶使用的滴定管是碱式滴定管
B.在不同级别的标准色阶中Fe3+浓度差别越大,测定的硫酸亚铁铵的纯度误差越小
C.配制标准色阶时,加入一定量的盐酸的目的是抑制Fe3+的水解
D.用待测产品溶液与标准色阶比较,可以准确确定产品纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com