
����Ŀ����ͼ��ʾ�����Թܷ���ʢ25��ʱ����ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���5mL�������Թ��У�������������⣨��ʾ���������Ƶ��ܽ�����¶����߶����ͣ�
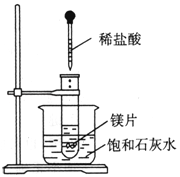
��1��ʵ���й۲쵽�������� ��
��2���������������ԭ���� ��
��3��д���йط�Ӧ�����ӷ���ʽ ��
��4����ʵ����֪��MgCl2��Һ��H2�������� ��������������С����������������þƬ���������������
���𰸡���1��þƬ���д������ݣ�þƬ���ܽ⣬�ձ�����Һ����ǣ���2��þ�����ᷴӦ����H2���÷�ӦΪ���ȷ�Ӧ��Ca��OH��2��ˮ���ܽ�����¶����߶���С����3��Mg+2H+=Mg2++H2������4��С��
�������������������1��þ�����ᷴӦ�����Ȼ�þ���������÷�ӦΪ���ȷ�Ӧ���ų�������ʹ�ձ��б���ʯ��ˮ�¶����ߣ����������ܽ�������¶����߶����ͣ�����ʯ��ˮ�л����������Ƴ������������Կ���������Ϊ��
��2��þƬ���д������ݲ�������þƬ���ܽ⣻���ձ����������塣��þ�����ᷴӦ�����Ȼ�þ�����������ӷ���ʽΪ��Mg+2H+=Mg2++H2����
��3����Ӧ�������������������������ķ�ӦΪ���ȷ�Ӧ��þ�����ᷴӦ�����������÷�ӦΪ���ȷ�Ӧ����MgCl2��Һ��H2��������С��þƬ���������������


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д� ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ���ǣ� ��
A.����ͨ������У�CH3COOH+NH3�TCH3COO��+NH![]()
B.��̼����þ��Һ�мӹ���ʯ��ˮ��Mg2++2HCO ![]() +Ca2++2OH���TCaCO3��+2H2O+MgCO3��
+Ca2++2OH���TCaCO3��+2H2O+MgCO3��
C.����ʯ��ˮ��ϡ���ᷴӦ��Ca��OH��2+2H+�TCa2++2H2O
D.ϡ�������ͭƬ�ϣ�Cu+2H+�TCu2++H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ��ȼ���͵�ؼ���ǵĹ���ԭ��ʾ��ͼ������˵������ȷ���ǣ� �� 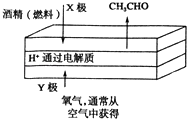
A.����������ʱ�ƾ�Ũ��Խ�������ǿ��Խ��
B.����ʱ����·��������ΪX��Y
C.��������X������pH����
D.����ܷ�ӦΪ2CH3CH2OH+O2�T2CH3CHO+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����ʯ�������ȵ�������( )
A. �Թ� B. ������ C. ���� D. Բ����ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�֡��˹��̵������·������ڳ��¡���ѹ�����������£�N2�ڴ���������ˮ������Ӧ����NH3��N2+3H2O2NH3+ ![]() O2��һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ�������Ӧʱ��3h����
O2��һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ�������Ӧʱ��3h����
T/�� | 30 | 40 | 50 |
����NH3��/��10��6 mol�� | 4.8 | 5.9 | 6.0 |
��ش��������⣺
��1��50��ʱ�ӿ�ʼ��3h����O2���ʵ����仯��ʾ��ƽ����Ӧ����Ϊmolh��1 ��
��2���÷�Ӧ������������ϵ������ͼ��ʾ����Ӧ���Ȼ�ѧ����ʽ�ǣ� �� 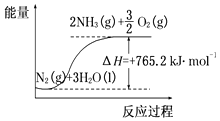
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�ӽṹģ�͵��ݱ�ͼ��ͼ�� 
���У���1��Ϊ������ʵ����ʽԭ��ģ�ͣ���2��Ϊ¬ɪ��������תʽԭ��ģ�ͣ���3��Ϊ��ķ�����Ѹ����ʽԭ��ģ�ͣ���4��Ϊ����������ѧԭ��ģ�ͣ���5��Ϊ�������ʽԭ��ģ�ͣ����з�����ʷ�ݱ�˳���һ�������ǣ� ��
A.��1����3����2����5����4��
B.��1����2����3����4����5��
C.��1����5����3����2����4��
D.��1����3����5����4����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ��Ȼ�����һ�����;�ˮ��������������Ũ�ȣ���AlT��ʾ���������ࣺ��ҪΪAl3+�ĵ�����̬����Ũ�ȣ���Ala��ʾ������ҪΪ[AlO4Al12��OH��24��H2O��12]7+���еȾۺ���̬����Ũ�ȣ���Alb��ʾ����Al��OH��3������̬����Ũ�ȣ���A1c��ʾ����
��1��һ�������£���1.0mol/LAlCl3��Һ�м���0.6mol/L��NaOH��Һ�����Ƶ�Alb����ԼΪ86%�ľۺ��Ȼ�����Һ��д������[AlO4Al12��OH��24��H2O��12]7+�����ӷ���ʽ�� ��
��2����Ĥ�����MD��Ũ���������ۺ��Ȼ�����Һ����Ũ����ʵ������в�ͬŨ�Ⱦۺ��Ȼ���������̬�ֲ����ٷ����������
AlT/��molL��1�� | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
����һ���¶��£�AlTԽ��pH���Խ����ԽС�����䡱����
���罫AlT=2.520molL��1�ľۺ��Ȼ�����Һ��ˮϡ�ͣ���ϡ��������Ҫ������Ӧ�����ӷ���ʽ�� ��
��Ĥ������Һ�¶ȶ����ۺ���̬�ٷ�����������Ũ�ȵ�Ӱ����ͼ1����T��80��ʱ��AlT�����½���ԭ���� �� 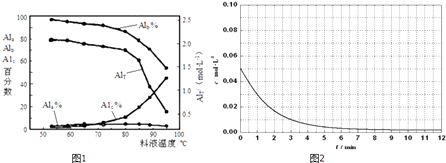
��3�����̼�Ȼ�ԭһ��������ʵ�����������Ʊ�����������ط�Ӧ���Ȼ�ѧ����ʽ���£���Al2O3��s��+AlCl3��g��+3C��s��=3AlCl��g��+3CO��g����H1=a kJmol��1
��3AlCl��g��=2Al��l��+AlCl3��g����H2=b kJmol��1
��ӦAl2O3��s��+3C��s��=2Al��l��+3CO��g����H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ������Ӧ�ٳ�ѹ����1900��ĸ����²��ܽ��У�˵����H0���������=����������
��4�������е���Ԫ�ؿ���ͨ������Ԫ��ת����Al3+ �� Ȼ����ˮ��Һ�������Լ���NH4��3C19H11O3��COO��3����Ʒ��Ϊ���������ã��ⶨ������������Һ�У�Al3+���������Լ���Ӧ������õ���ɫ�����ʣ����Ÿ÷�Ӧ�Ľ��У���Һ����ɫ���ϱ仯��������Һ��ɫ�뷴Ӧ��������Ũ�ȵĹ�ϵ������ɫ������������ȷ���û�ѧ��Ӧ�����ʣ����ڱ�ɫ������������ ��
A.pH��
B.Ԫ�ط�����
C.�ֹ��ȼ�
D.ԭ�����չ�����
��5����֪Al3++4X2[�� ![]() X2��1.5+]��X��ʾ��ɫ����
X2��1.5+]��X��ʾ��ɫ���� ![]() X21.5+��ʾ��ɫ���ʣ�ͨ����ɫ�����õ�25��ʱAl3+Ũ����ʱ��ı仯��ϵ��ͼ2��ʾ������ͬһͼ�л��
X21.5+��ʾ��ɫ���ʣ�ͨ����ɫ�����õ�25��ʱAl3+Ũ����ʱ��ı仯��ϵ��ͼ2��ʾ������ͬһͼ�л�� ![]() X21.5+Ũ����ʱ��ı仯���� ��
X21.5+Ũ����ʱ��ı仯���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ��������A��B��C��D��X��Y����������ͼת����ϵ���������ʺ�������ȥ��
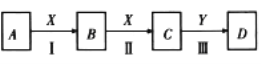
��1����AΪNaOH��Һ��XΪCO2��D�dz�������Y��Ϊ________������ţ���
A��SO3 B��Ba(OH)2 C��H2SO4 D��CaO
��2����AΪ������FeS2����D��H2SO4����Ӧ��Ļ�ѧ����ʽΪ_________________________��
��3����AΪ����ˮ�ʼ��Ե����壬��A��D��Ӧ���ɵ�һ�ֻ��ʵĻ�ѧʽΪ_____________����Ӧ��Ļ�ѧ����ʽΪ__________________��D��Ũ��Һ��̿��Ӧ�Ļ�ѧ����ʽ__________________________��
��4����A��X��Ϊ���ʣ���Ӧ��������ǰ�ɫ�������ڿ�����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ����ӦII�����ӷ���ʽΪ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС����̽��̼����Ԫ�صķǽ����Ե����ǿ����ʵ��װ�����£�
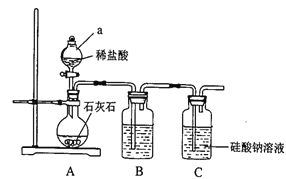
��1�����Ӻ�װ�ú�ʵ��ǰ������е�һ��������_________������a������Ϊ______��
��2��Bװ����ʢ�ŵ��Լ���_________��C�з�����Ӧ�Ļ�ѧ����ʽΪ_________��
��3������ȤС����ƴ�ʵ��ͨ��_________����ʵ���������ж�̼�ķǽ�����ǿ�ڹ�ķǽ����ԡ�
��4����С���һλͬѧ��Ϊ�����ô�ʵ��װ�ü�ҩƷ��Ҳ����֤���ǽ�����Cl>C>Si,���Ƿ�ͬ���ͬѧ�Ĺ۵㣿_________���ͬ�⡱��ͬ�⡱����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com