
【题目】原子结构模型的演变图如图: 
其中,(1)为道尔顿实心球式原子模型;(2)为卢瑟福行星运转式原子模型;(3)为汤姆生葡萄干面包式原子模型;(4)为近代量子力学原子模型;(5)为玻尔轨道式原子模型.下列符合历史演变顺序的一组排列是( )
A.(1)(3)(2)(5)(4)
B.(1)(2)(3)(4)(5)
C.(1)(5)(3)(2)(4)
D.(1)(3)(5)(4)(2)
科目:高中化学 来源: 题型:
【题目】有关物质分类或归类正确的是( )
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚苯乙稀、HD ③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同素异形体:C60、C70、金刚石、石墨
A.①③④
B.③⑤
C.②③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见单质,其对应元素的原子质子数依次增大,甲、乙、丙、丁为常见化合物.它们之间有如下转化关系:
回答下列问题:
(1)A的化学式为;乙的化学式为 .
(2)D与甲反应的化学方程式为 .
(3)B与NaOH溶液反应的离子方程式为 , 该反应的氧化剂为 .
(4)B生成D的反应称为反应,实验室中,进行这个反应的操作为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B ![]() 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
①原混和气体的体积为1.2V升;
②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升;
④反应达平衡时气体B消耗掉0.05V升.
A.②③
B.②④
C.①③
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试完成下列问题(提示:氢氧化钙的溶解度随温度升高而降低)
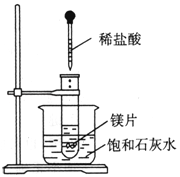
(1)实验中观察到的现象是 ;
(2)产生上述现象的原因是 .
(3)写出有关反应的离子方程式 .
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片的盐酸的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分PbO2→Pb2O3→Pb3O4→PbO.现将a mol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2 . 加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol.试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式 .
(2)用含x与a的表达式表示产生的O2、Cl2的物质的量n(O2)= , n(Cl2)= .
(3)写出y与a、x的函数关系式: .
(4)若两步反应中O2和Cl2的物质的量之比为5:3,则剩余固体中含有的物质为;其物质的量之比为 .
(5)PbO2和Pb经常作制造蓄电池的原材料,铅蓄电池的工作原理:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O.现有一种生产NH4NO3的新工艺,电解NO制备NH4NO3 , 其工作原理如图所示,为使电解产物全部转化为NH4NO3 , 需补充物质A,A是 , 说明理由: . 生产1吨硝酸铵需消耗Pb的物质的量是kg(保留到整数).
2PbSO4+2H2O.现有一种生产NH4NO3的新工艺,电解NO制备NH4NO3 , 其工作原理如图所示,为使电解产物全部转化为NH4NO3 , 需补充物质A,A是 , 说明理由: . 生产1吨硝酸铵需消耗Pb的物质的量是kg(保留到整数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.某芳香烃的分子式为C10H14 , 它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种
B.按系统命名法,有机物 ![]() 的命名为2,2,4,4,5﹣五甲基﹣3,3﹣二乙基己烷
的命名为2,2,4,4,5﹣五甲基﹣3,3﹣二乙基己烷
C.甲烷、甲醛、尿素都不存在同分异构体
D.某有机物含有C,H,O,N四种元素,其球棍模型为 ![]() ,该有机物的结构简式为
,该有机物的结构简式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NA代表阿伏加德罗常数,1molC4H10中含共价键数目为14NA
B.某反应的△H=﹣88kJ?mol﹣1 , 则正反应活化能一定小于88kJ?mol﹣1
C.已知某温度下,Kw=l×10﹣13 , 若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9
D.将浓度为0.1 mol?L﹣1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变, ![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D,原子序数依次增大,A原子的最外电子层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A元素最高价氧化物的电子式为_________,D元素的某种核素中质子数和中子数相等,该核素组成符号为_______。
(2)化合物E中存在的化学键类型为_________。
(3)A、B、C的原子半径从大到小的顺序__________________。(用对应原子符号表示);B、C、D 的简单离子的半径从大到小的顺序__________________。(用对应的离子符号表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com