
A、nCH2=CH2
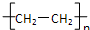 | ||
B、CH2=CH2+HCl
| ||
C、C6H12O6
| ||
D、 |
| 18 |
| 24 |
| 12 |
| 14 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验 编号 |
HA物质的量 浓度/(mol?L-1) |
NaOH物质的量 浓度/(mol?L-1) |
混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
| c(OH-) |
| c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
| B、在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 |
| C、积极推广太阳能、风能、地热能及核能等的使用,减少化石燃料的使用 |
| D、雾霾天气与燃煤、机动车、工业、扬尘等污染源排放量大有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖的结构简式:CH2OH(CHOH)4CHO |
B、聚丙烯的结构简式: |
C、Cl-的结构示意图: |
D、甲烷的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .将1mol化学式为CnH2n-4(不含C≡C和C=C=C结构)经上述方法处理后,得到的有机物和羰基(C=O)的物质的量不可能是( )
.将1mol化学式为CnH2n-4(不含C≡C和C=C=C结构)经上述方法处理后,得到的有机物和羰基(C=O)的物质的量不可能是( )| A | B | C | D | |
| 有机物 | 1mol | 3mol | 5mol | 4mol |
| 分子中羰基 | 2mol | 4mol | 8mol | 6mol |
| A、A |
| B、B |
| C、C D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用过氧化氢从海带中提碘:2I-+H2O2+2H+═I2+2H2O |
| B、用二氧化硫的溶液吸收溴蒸气:Br2+SO2+2H2O═4 H++2 Br-+SO42- |
| C、用氯气氧化氢溴酸:Cl2+2 Br-=Br2+2 Cl - |
| D、用醋酸中和氢氧化钠溶液:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com