
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、①③⑥ |
| 总质量 |
| 体积 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )| A、B极为原电池的正极 |
| B、A、B、C可能分别为Zn、Cu、稀盐酸 |
| C、C中阳离子向A极移动 |
| D、A极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、nCH2=CH2
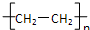 | ||
B、CH2=CH2+HCl
| ||
C、C6H12O6
| ||
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家最近在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键),下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键),下列说法正确的是( )| A、X分子中在同一平面上的碳原子最多5个 |
| B、X能使溴的四氯化碳溶液褪色 |
| C、X是一种在常温下能稳定存在的液态烃 |
| D、充分燃烧等质量的X和甲烷,X消耗氧气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2(aq)+2HCl(aq)=BaCl2 (aq)+2H2O (l)△H=-114.6KJ/mol | ||||
| B、Ba(OH)2(aq)+2HCl(aq)=BaCl2 (aq)+2H2O (l)△H=+114.6KJ/mol | ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示不同温度和压强下在一定容积的密闭容器中,对可逆反应4L(g)?2M(g)+N(g)△H>0,平衡状态时(P1>P2)图中y轴是指( )
如图所示不同温度和压强下在一定容积的密闭容器中,对可逆反应4L(g)?2M(g)+N(g)△H>0,平衡状态时(P1>P2)图中y轴是指( )| A、L的体积分数 |
| B、混合气体的总物质的量 |
| C、混合气体的平均分子量 |
| D、气体混合物的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com