
【题目】保健品黄金搭档组合维生素片中含钙、铁、锌、硒等元素,其中属于组成生物体的大量元素的是
A. 钙 B. 铁 C. 锌 D. 硒
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】对于胃溃疡较重的病人,不适合使用的抑酸剂是( )。
A.Mg(OH)2 B.Al(OH)3 C.NaHCO3 D.Na3C6H5O7·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )

A. 途径②增大O2浓度可提高SO2转化率
B. 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C. 途径②中SO2和SO3均属于酸性氧化物
D. 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2(g)为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
A.Cu与浓硝酸反应比与稀硝酸反应快
B.Cu能与浓硝酸反应,而不与浓盐酸反应
C.Cu与浓硫酸能反应,而不与稀硫酸反应
D.N2与 O2在常温、常压下不反应,放电时可反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.

已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是 .
(2)C中得到足量KClO后将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 .再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,
② ,
③ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由_____________ .
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4﹣+FeO42﹣═Fe(OH)3↓+CrO42﹣+OH﹣;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为: .
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为: .计算该K2FeO4样品的纯度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ==2xCO2+N2
当转移电子物质的量为0.8x mol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入2 mol CO和6 mol H2
(2)一定条件下,CO与H2可合成甲烷,反应方程式为CO(g)+3H2(g)![]() CH4 (g)+H2O(g)
CH4 (g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 。
②已知H2(g)、CO(g)、和CH4 (g)的燃烧△H分别等于aKJ/mol和cKJ/mol,写出CO与H2反应生成CH4和CO2的热化学方程式: 。
(3)甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
(4)CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用回收的镁铝合金制取氢气。现有10.8g镁铝合金,下列说法正确的是( )
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6molH2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45molH2
C.常温下与足量2mol/LH2SO4反应,放出H2的量在0.45mol~0.6mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45mol~0.6mol之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Cu(NH3)4]SO4·H2O是一种重要的染料及合成农药中间体,受热可分解。某化学课外小组设计了如下实验(部分夹持装置略)验证它的部分分解产物,请回答问题:
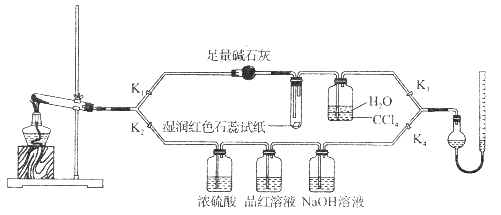
(1)连接装置,_________________________,在各装置中加入相应的药品和试剂。
(2)打开K2、K4,闭合K1、K3,加热一段时间后观察到品红溶液褪色,写出NaOH溶液中发生反应的离子方程式_____________________。
(3)打开K1、K3,闭合K2、K4,继续加热一段时间后观察到湿润红色石蕊试纸变蓝,证明分解产物中含有________________(填化学式)。
(4)CCl4的作用是__________________。
(5)加热过程中,还生成Cu、N2和H2O。写出[Cu(NH3)4]SO4·H2O分解的化学方程式________________。
(6)若实验中称取a g [Cu(NH3)4]SO4 · H2O,收集到b mL N2(已换算成标准状况),[Cu(NH3)4]SO4·H2O的分解率表达式为_______________。
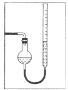
(7)量气管读数时需注意的事项有:①气体冷却到室温;②量气装置两侧液面相平;③______________。若某同学按右图所示读数,则计算出的分解率_______________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com