
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。

请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
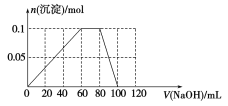
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

【答案】(1)13;(2)Al(OH)3+OH-===AlO2-+2H2O;(3)生成白色沉淀;
(4)
【解析】
试题分析:(1)A点沉淀达到最大,OA段发生离子反应方程式为:Al3++3OH-=Al(OH)3↓,两者物质的量之比为1:3;(2)氢氧化铝属于两性氢氧化物,因此AB段发生离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O;(3)B中溶质为NaAlO2,因为碳酸的酸性强于偏铝酸,因此有2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,因此有白色沉淀产生;(4)Al3+得OH-的能力强于NH4+,因此先发生Al3++OH-=Al(OH)3↓,生成最大沉淀时,消耗NaOH的体积为60mL,然后发生NH4++OH-=NH3·H2O,此时沉淀的质量不变,此阶段消耗的NaOH的体积为20mL,最后发生的是Al(OH)3+OH-=AlO2-+2H2O,此时消耗的NaOH的体积为20mL,因此图像是:


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】 两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
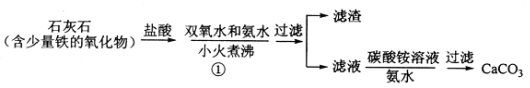
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
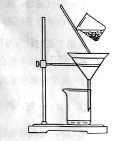
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
CaCO3![]() 滤液
滤液![]()
![]() 白色晶体
白色晶体
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
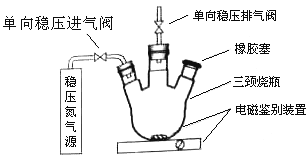
1、测定原理:
碱性体积下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-=2 MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-
2、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200ml水样
c.向烧瓶中依次迅速加入1mlMnSO4无氧溶液(过量)2ml碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2ml硫酸无氧溶液至反应②完全,溶液为中性或若酸性。
e.从烧瓶中取出40.00ml溶液,以淀粉作指示剂,用0.001000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50ml,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填是或否)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于等质量的14CO2与N218O的说法不正确的是
A.分子数之比为1 : 1 B.原子数之比为1:1
C.密度之比为1 : 1 D.中子数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
B.油脂都不能使溴的四氯化碳溶液褪色
C.石油分馏、煤的干馏均为物理变化
D.淀粉、蛋白质和天然橡胶均是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Q、R、Z、T、U分别代表原子序数依次增大的元素。X是原子半径最小的元素,短周期中Q原子含有的未成对电子数最多,R和T属同族,T的原子序数是R的两倍,Z的单质的同周期中熔点最高;U5+的核外电子排布和氩元素相同。
(1)U基态原子的原子结构示意图为 。
(2)在(QX4)2TR4的晶体中存在的化学键类型有 。
a.离子键 b.共价键 c.配位键 d.金属键
(3)Q、R、T所对应元素的第一电离能由大到小的顺序是 (填元素符号)。
(4)TR2是 分子(填“极性”或“非极性”)。ZR2晶体结构如图I,6g ZR2中所含Z—R键的数目为 。
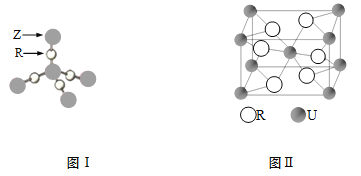
(5)U和R形成的化合物的晶胞结构如图II所示,该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有很多重要的化合物。特别是Cu2+核外电子的特殊构型,其能与很多含有氧或氮元素的配体[如NH3、乙二胺(H2N—CH2—CH2—NH2)、乙酰丙酮(CH3COCH2COCH3)等]形成配合物。
(1)C、N、O元素的电负性由小到大的顺序是 。
(2)[Cu(NH3)4]2+呈深蓝色,该粒子中配位体的空间构型为 。
(3)酞菁铜也是Cu2+的一种配合物,被广泛用于墨水生产,其结构如图。请用箭头标出其中的配位键 ,该分子中氮原子的杂化方式为 。
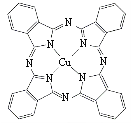
(4)CuCl2在湿空气中潮解,易溶于水、乙醇和丙酮,熔点约100℃。推测氯化铜的晶体类型为 。
(5)Cu的晶胞如图所示,铜原子的配位数为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种锂钒氧化物热电池装置如图所示。其电池总反应为xLi+LiVO8=Li1+xV3O8,工作时需先引发铁和氯酸钾反应使共晶盐融化。下列说法正确的是( )
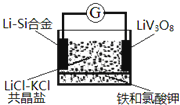
A.Li—Si合金为该热电池的正极
B.电池放电时Cl-移向LiV308电极
C.LiCl-KCl共晶盐可用LiCl和KCl的混合水溶液代替
D.放电时,正极反应式为LiV3O8+xLi++xe-=Li1+xV3O8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com