
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气体;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl SiHCl3+H2);
SiHCl3+H2);
③SiHCl3与过量的H2在1 100~1 200 ℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应,在空气中易自燃。
请回答:
(1)第一步制取粗硅的化学反应方程式为 。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为 。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):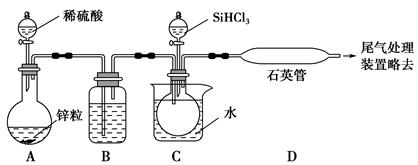
①装置B中的试剂是 ,装置C中的烧杯需要加热,目的是 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式是 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:计算题
普通玻璃中,Na2SiO3、CaSiO3、SiO2的物质的量之比是Na2SiO3∶CaSiO3∶SiO2=1∶1∶4。
(1)若以aNa2O·bCaO·mSiO2形式表示此玻璃的组成,则a∶b∶m=____________。
(2)若要制备1 000 kg上述玻璃,需要原料各多少千克?共可产生标准状况下的CO2气体多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(18分)I.实验室制备、收集干燥的SO2,所需仪器如下。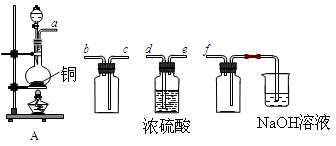
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: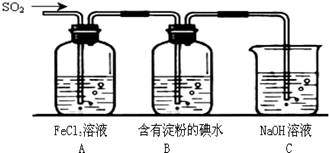
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 ;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组设计如图实验装置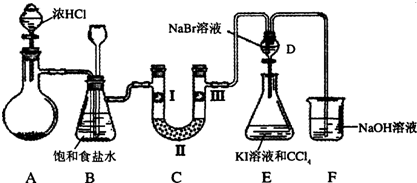
(1)若装置A中的固体药品为KClO3,则写出离子方程式 。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是 。
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是 , 。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象 。(夹持装置略去)制备Cl2并探究氯气的相关性质:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质: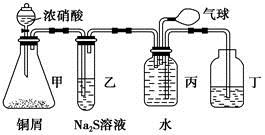
(1)写出甲中反应的离子方程式:_____________________
乙中的现象是__________________________________________________
可证明NO2的氧化性;在丙中鼓入空气后的现象是_____________________________________,可证明NO的还原性。
(2)实验前丙中充满水的作用是________________________________________
(用反应的化学方程式和简要文字回答)。
(3)小华对上述实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是_________________________________________________。
你认为怎样才能准确证明NO2的氧化性?___________________________
(简要回答出原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成 CO2、SO2和H2O。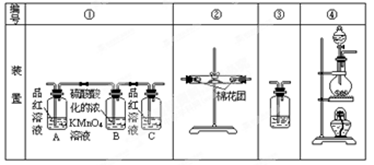
(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是: 。(2分)
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号) → → → 。(2分)
(3)B瓶溶液的作用是 。(2分)本实验中能说明二氧化硫具有漂白性的实验现象是 。(2分)③中反应的离子方程式为 。(2分)
(4)装置②中所盛是无水硫酸铜,现象是 。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com