
某化学兴趣小组为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质: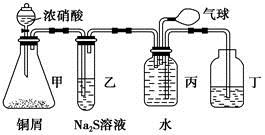
(1)写出甲中反应的离子方程式:_____________________
乙中的现象是__________________________________________________
可证明NO2的氧化性;在丙中鼓入空气后的现象是_____________________________________,可证明NO的还原性。
(2)实验前丙中充满水的作用是________________________________________
(用反应的化学方程式和简要文字回答)。
(3)小华对上述实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是_________________________________________________。
你认为怎样才能准确证明NO2的氧化性?___________________________
(简要回答出原理和现象即可)。
科目:高中化学 来源: 题型:计算题
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.图10、图11分别是实验室模拟合成氨及氨催化氧化的装置
(1)氮气和氢气通过图10装置,该装置中浓硫酸的作用是控制气体流速和 。
(2)用图11装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是 ,写出该装置中氨氧化的化学方程式 。反应结束后锥形瓶内的溶液中含有H+、OH-、 离子、 离子。
II.下列有关硝酸事实的解释合理的是
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子 |
| C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性 |
| D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
| 操作 | 现象 |
| a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 | |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了探究AgNO3的热稳定性,某化学兴趣小组设计了如下实验。用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。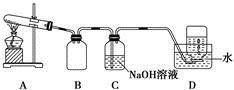
(1)装置B的作用是 。
(2)经小组讨论并验证该无色气体为O2,其验证方法是 。
(3)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气体;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl SiHCl3+H2);
SiHCl3+H2);
③SiHCl3与过量的H2在1 100~1 200 ℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应,在空气中易自燃。
请回答:
(1)第一步制取粗硅的化学反应方程式为 。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为 。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):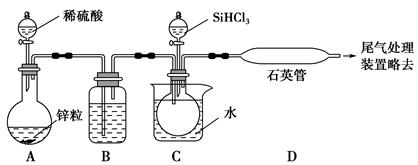
①装置B中的试剂是 ,装置C中的烧杯需要加热,目的是 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式是 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组欲设计使用如下装置验证:铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中溶液的体积变化)试回答下列问题: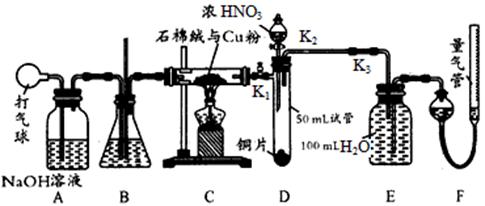
(1)在铜和浓硝酸反应前,挤压打气球,经A、B、C三个装置后,进入装置D中的气体是 (填化学式),通入该气体的目的是 ;进行此步操作时应关闭 (填“K1”“K2”或“K3”,下同),打开 。
(2)若装置C的硬质玻璃管中出现堵塞,则装置B中可能出现的现象是 。
(3)关闭K1、K2,打开K3,由分液漏斗向装置D的试管中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向装置D的试管中加入CCl4至满。则装置D的试管中一定发生的离子反应方程式为 。
(4)从装置E所得溶液中取出25.00 mL,用0.1000 mol/L的NaOH溶液进行中和,当恰好呈中性时消耗NaOH溶液18.00mL ,则装置E中所得硝酸的物质的量浓度为 。
(5)实验前量气管的液面读数为368.50 mL,实验后量气管的液面读数为224.00 mL。则上述铜和一定量的浓硝酸反应中 (填“有”或“无”)NO生成,写出推导过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是 。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是 ,NaHCO3溶液可以吸收 。
(3)上述装置中,B物质是 。用这个实验得到的气体测定CO2的相对分子质量,如果B物质失效,测定结果 (填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出 ,后溶出 。
(6)上述测定实验中,连续 ,说明样品已经恒重。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。 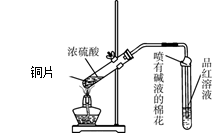
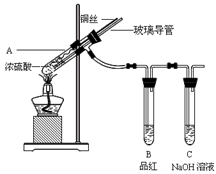
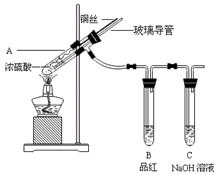 图1 图2
图1 图2
(1)比较两实验装置,图2装置的优点是:① ;② 。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
| A.过量铁粉 | B.氯化钡溶液 | C.银粉 | D.碳酸氢钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有关实验: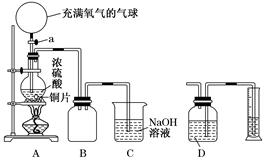
(1)先关闭活塞a,将6.4 g铜片和10 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:
打开活塞a之前___________________________________________________;
打开活塞a之后___________________________________________________。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________________(填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为__________________________________________________;再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为________mol(用含a、b的表达式来表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com