
����12�֣�
��1����CO2Ϊ̼Դ��ȡ��̼�л���һֱ�ǻ�ѧ������о��ȵ㣬CO2������ȡ��̼���ķ�Ӧ���£�
��ӦI��CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ��H=��49.0kJ/mol
��ӦII��2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) ��H=��173.6kJ/mol
д����CH3OH(g)�ϳ�CH3CH2OH(g)�ķ�Ӧ���Ȼ�ѧ����ʽ_______________
��2��������أ�K2FeO4��������һ����Ҫ��������м�ǿ��������
�ٵ�ⷨ�ǹ�ҵ���Ʊ�K2FeO4��һ�ַ���������Ϊ�����������������Һ��Ȼ����������Һ�м���KOH�����ʱ����������Ӧ����FeO42-���õ缫��ӦʽΪ_________________
����MnO2��Zn������ƣ�K2FeO4��ZnҲ������ɼ��Ե�أ�K2FeO4�ڵ�������������ϣ���缫��ӦʽΪFeO42-+3e-+4H2O=Fe(OH)3+5OH-����õ���ܷ�Ӧ�����ӷ���ʽΪ__________________
��3��amol FeS��bmol FeOͶ�뵽VL��C mol/L��������Һ�г�ַ�Ӧ����NO���壬���ó�����Һ�ɷֿɿ�����Fe(NO3)3��H2SO4�Ļ��Һ����Ӧ��δ����ԭ���������Ϊ_____
�٣�a+b����63g �ڣ�a+b����189g �ۣ�a+b��mol ��VC��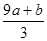 mol
mol
��1��2CH3OH(g)=CH3CH2OH(g)+H2O(g) ��H= -75.6kJ/mol
��2����Fe��6e- +8OH- = FeO42- + 4H2O
��3Zn + 2FeO42- + 8H2O = 2Fe(OH) 3 + 3Zn(OH)2 + 4OH-
��3���ڢ�
��������
�����������1�����ݸ�˹���ɿ�֪����-2���ٵõ�Ŀ�귴Ӧ��������CH3OH(g)�ϳ�CH3CH2OH(g)���Ȼ�ѧ����ʽΪ��2CH3OH(g)=CH3CH2OH(g)+H2O(g) ��H= -75.6kJ/mol��
��2������������������ʧ���ӣ����Ե缫��ӦΪFe��6e- +8OH- = FeO42- + 4H2O
��ZnΪ���������Ը����ĵ缫��ӦΪZn��2e-+2OH-= Zn(OH)2�������ܵ����ӷ���ʽΪ3Zn + 2FeO42- + 8H2O = 2Fe(OH) 3 + 3Zn(OH)2 + 4OH-��
��δ����Ӧ�����������Һ�е�NO3-����Ϊ��Ӧ�����Һ���Կ�����Fe(NO3)3��H2SO4�Ļ��Һ��������Һ�е�NO3-���Ը���Fe3+���������㣬��3(a+b)mol��63g/mol=(a+b)��189g�������Ը�������������㣬������������Ӧ��һ������������ת��ΪNO��һ����δ����ԭ��NO3-����ʽ��������Һ�У����ݵ�ʧ��������ȿ����n(NO)=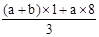 =
=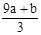 ������NO3-����ΪVC-
������NO3-����ΪVC-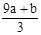 ��
��
���㣺��ѧ��Ӧ�е������仯��ԭ��ء����ء�����ļ���
�����������ۺ���ǿ���ѶȽϴ���Ҫ����ѧ��������������������ڸ߿��ȵ�ϰ�⡣


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ÿ��2�֣���12�֣�.
��1������˵������ȷ���� ��
A.��100mL������ƿȷ��ȡ100mLҺ��
B.��Һʱ����Һ©�����²�Һ����¿��������ϲ�Һ����Ͽڵ���
C.��������ƽ����NaCl����ʱ��NaCl���ڳ���ֽ�ϣ�����NaOH����ʱ��NaOH����С�ձ���
��2���ش��������⣨����ţ���
���������У���©��������ƿ��������ƿ����ƽ�ݷ�Һ©������Ͳ��ȼ�ճס�
���������ʷ������ �����и������ʷе㲻ͬ���������ʵ������� ��
��3�����ʵ����Լ�����ȥ���������������е��������ʣ�д���йصķ�Ӧ����ʽ��
��������������� ��
FeCl3�������FeCl2 ��
���� Na2CO3�������NaHCO3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�����ʡ���о�У������ѧ�ڵ�һ��������ѧ�Ծ� ���ͣ������
��ͼ��A��B��C��D��EΪ���ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�������֪��C+G��B+H���ų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ�G�����Ǵ��������Ҫ�ɷ֣���I��һ�ֳ������������壬����E������Ӧ��2E+I��2F+D��F��EԪ�ص���������Ϊ60%���ش��������⣨ÿ��2�֣���12�֣�
��1����Ӧ�ٵĻ�ѧ����ʽ��
��2��������I�������ڵĻ�ѧ���� ��������ӡ����ԡ��Ǽ��ԡ���
��3����ȡ11.9gB��C��E�Ļ����ù�����NaOH��Һ�ܽ���ˡ�����ʣ���������Ϊ9.2g����ȡ��������B��C��E�Ļ������ϡ������ȫ�ܽ⣬���ռ������������6.72L����ʣ��Ļ��Һ�����������NaOH��Һʹ���еĽ���������ȫ�����������������Ϊ�� ��
A��27.2g B��7.8g C��2.7g D��19.4g
(4)C�������NaOH��Һ��Ӧ�����ӷ���ʽ�ǣ�
��5����G���ڹ�����ϡ�����У����������е�Fe3+�ķ����� �����������е�Fe2+�ķ�����
A���μ�KSCN��Һ����Һ��Ѫ��ɫ
B�������ۣ���Һ��dz��ɫ
C����������KMnO4��Һ��Ѹ����ɫ
D���μ�NaOH��Һ���а�ɫ������Ѹ�ٱ�ɻ���ɫ���ת��Ϊ�� ��ɫ
��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ɽ��ʡ��������ˮһ�и���12���¿�������⻯ѧ�Ծ����������� ���ͣ������
����12�֣�
��1����CO2Ϊ̼Դ��ȡ��̼�л���һֱ�ǻ�ѧ������о��ȵ㣬CO2������ȡ��̼���ķ�Ӧ���£�
��ӦI��CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ��H=��49.0kJ/mol
��ӦII��2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) ��H=��173.6kJ/mol
д����CH3OH(g)�ϳ�CH3CH2OH(g)�ķ�Ӧ���Ȼ�ѧ����ʽ_______________
��2��������أ�K2FeO4��������һ����Ҫ��������м�ǿ��������
�ٵ�ⷨ�ǹ�ҵ���Ʊ�K2FeO4��һ�ַ���������Ϊ�����������������Һ��Ȼ����������Һ�м���KOH�����ʱ����������Ӧ����FeO42-���õ缫��ӦʽΪ_________________
����MnO2��Zn������ƣ�K2FeO4��ZnҲ������ɼ��Ե�أ�K2FeO4�ڵ�������������ϣ���缫��ӦʽΪFeO42-+3e-+4H2O=Fe(OH)3+5OH-����õ���ܷ�Ӧ�����ӷ���ʽΪ__________________
��3��amol FeS��bmol FeOͶ�뵽VL��C mol/L��������Һ�г�ַ�Ӧ����NO���壬���ó�����Һ�ɷֿɿ�����Fe(NO3)3��H2SO4�Ļ��Һ����Ӧ��δ����ԭ���������Ϊ_____
�٣�a+b����63g �ڣ�a+b����189g �ۣ�a+b��mol ��VC�� mol
mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ������ѵ���и�һ����ĩ���Ի�ѧ�Ծ����������� ���ͣ�ʵ����
��ÿ��2�֣���12�֣�.
��1������˵������ȷ���� ��
A.��100mL������ƿȷ��ȡ100mLҺ��
B.��Һʱ����Һ©�����²�Һ����¿��������ϲ�Һ����Ͽڵ���
C.��������ƽ����NaCl����ʱ��NaCl���ڳ���ֽ�ϣ�����NaOH����ʱ��NaOH����С�ձ���
��2���ش��������⣨����ţ���
���������У���©��������ƿ��������ƿ����ƽ�ݷ�Һ©������Ͳ��ȼ�ճס�
���������ʷ������ �����и������ʷе㲻ͬ���������ʵ������� ��
��3�����ʵ����Լ�����ȥ���������������е��������ʣ�д���йصķ�Ӧ����ʽ��
��������������� ��
FeCl3�������FeCl2 ��
���� Na2CO3�������NaHCO3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���Ĵ�ʡ��һ5���¿���ѧ�Ծ��������棩 ���ͣ������
�����12�֣���1������A��B��C��D��E����Ԫ�أ�A��ԭ�Ӻ���û�����ӣ�B��CԪ�ش���ͬһ���ڣ�C��ԭ�Ӱ뾶��С��B��C��������֮��Ϊ27��������֮��Ϊ5��54 g D�ĵ��ʸ��������ᷴӦ������D3����67.2 L����״����������E��C���γ�E2C�����ӻ������E��C��Ԫ�صļ����Ӿ�����ͬ���Ӳ�ṹ��

��B��D������������Ӧˮ�������Ӧ�����ӷ���ʽΪ�� ��
���õ���ʽ��ʾC��E�γ�E2C�Ĺ��̣� ��
��2��Ԫ�������ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʡ���ͼ��Ԫ�����ڱ���һ���֡�
����Ӱ����Ԫ��N��Ԫ�����ڱ��е�λ��Ϊ ��
����һ�������£�S��H2��Ӧ��һ����(������Ϊ��Ӧ���еij̶�)�����жϣ�����ͬ������Se��H2��Ӧ���ȱ�S��H2��Ӧ�� ������ ��(ѡ���������С������ͬ��)
��Br2���н�ǿ�������ԣ�SO2���н�ǿ�Ļ�ԭ�ԣ���SO2����ͨ����ˮ��Ӧ���ӷ���ʽ��__________________________________________��
������˵����ȷ����
A��C��N��O��F��ԭ�Ӱ뾶����ԭ���������������С
B��Si��P��S��ClԪ�صķǽ��������ź˵���������Ӷ���ǿ
C���ɱ�������Һ̬ˮת��Ϊ��̬��Ҫ�˷������ڵĹ��ۼ�
D��HF��HCl��HBr��HI�����ȶ������μ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com