



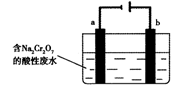


科目:高中化学 来源:不详 题型:单选题

| A.a为正极,b为负极 | B.a为负极,b为正极 |
| C.a为阳极,b为阴极 | D.a为阴极,b为阳极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
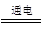 4Na+O2↑+2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH
4Na+O2↑+2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH 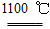 Fe3O4+2H2↑+4Na↑。下列有关说法正确的是 ( )
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是 ( )| A.电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-=H2↑+O2↑ |
| B.若用戴维法与吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| C.吕萨克法制钠的原理是利用铁的还原性比钠强 |
| D.目前工业上常用电解熔融氯化钠法制钠(如下图),电解槽中石墨为阳极,铁为阴极 |
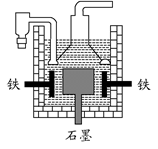
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
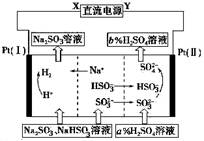
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuCl2 (CuO) | B.NaOH (NaOH) |
| C.CuSO4 (CuCO3) | D.NaCl (NaOH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用铜片连接电源的正极,另一电极用铂片 |
| B.用碳棒连接电源的正极,另一电极用铜片 |
| C.用氢氧化钠溶液吸收阴极产物 |
| D.用带火星的木条检验阳极产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4 | B.Na2SO4 | C.CuCl2 | D.NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com