
【题目】如图所示装置做如下实验,其中收集方法及所加试剂、现象、结论均正确的是

选项 | 气体 | 试剂 | 现象 | 结论 |
A | NH3 | 酚酞溶液 | 溶液变红色 | NH3的水溶液呈碱性 |
B | C12 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
C | HCl | 硅酸钠溶液 | 生成白色沉淀 | C1的非金属性比Si强 |
D | Y | 酸性KMnO4溶液 | 溶液褪色 | Y一定是SO2 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:


步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 | B.洗涤晶体可选用0℃的苯 |
C.加热至160℃的主要目的是除去苯 | D.该步骤的目的是除去乙醚和可能残留的溴 |
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-="===Mg" Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HC![]() 占95%,写出海水中碳酸氢盐水解的离子方程式____________________________。
占95%,写出海水中碳酸氢盐水解的离子方程式____________________________。
(2)在海洋碳循环中,通过如图所示的途径固碳。

①写出钙化作用的离子方程式(根据流程图中的箭头读出部分反应物与生成物)_____________________________________。
②同位素示踪法证实光合作用释放出的O2只来自H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:____+____![]() (CH2O)x+x18O2+xH2O
(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂(标出导管进、出洗气瓶的情况和加酸酸化的仪器并指出所用的酸)。
____
指出两个盛装NaOH溶液的洗气瓶的作用分别为:
______________________________;______________________________。

②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用HCl溶液滴定,从而测得海水中溶解无机碳的浓度。
(4)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①a室发生的电极反应生成的离子与海水中的HC![]() 发生反应的化学方程式为_______________,该反应在_____室进行(填“a”、“b”或“c”)。
发生反应的化学方程式为_______________,该反应在_____室进行(填“a”、“b”或“c”)。
②b室排出的海水不可直接排回大海,应用该装置中____室产生的物质处理(填“a”、“b”或“c”),使海水接近中性后排回大海。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如右图所示。下列判断不正确的是

A. 在0-50min之间,pH=2和pH =7时H2O2的分解百分率相等
B. 溶液酸性越强,H2O2的分解速率越大
C. 相同条件下,H2O2的起始浓度越小,分解速率越大
D. 在20—25 min之间,pH=10时H2O2的平均分解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在水溶液中大量共存的是( )
A.I-、K+、ClO-、OH-B.Fe2+、H+、SO42-、NO3-
C.Al3+、K+、HCO3-、OH-D.Na+、Mg2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去)。
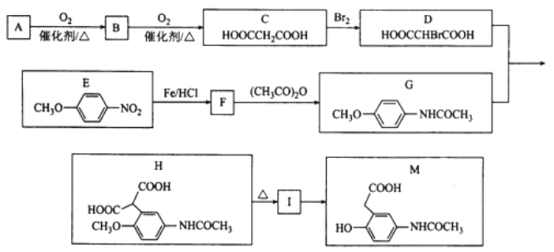
已知:①A的密度是相同条件下H2密度的38倍,其分子的核磁共振氢谱中有3组峰;
②![]()
请回答下列问题:
(1)A的结构简式为___________________,M的分子式为_____________________。
(2)G+D→H的化学方程式为___________________________。
(3)H不可能发生的反应为_______________(填编号)。
A.加成反应 B.氧化反应 C.取代反应 D.消去反应
(4)同时满足下列条件的E的同分异构体有_________________种。
①能与FeCl3溶液发生显色反应
②能与NaHCO3反应
③含有—NH2
④苯环上有处于对位的取代基
(5)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com