
本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
将3.2g铜片投入到一定量的浓HNO3中,当收集到1.792L的气体(已换算为标准状况)时,金属铜恰好全部溶解.(相对原子质量:Cu:64)
求:(1)反应中消耗HNO3的物质的量是多少?
(2)被还原的HNO3的物质的量是多少?
(3)转移电子的物质的量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述正确的是( )
|
| A. | 两原子之间形成共价键时,可形成2个σ键 |
|
| B. | 将铁制品做炊具,金属键没有被破坏 |
|
| C. | 温度越高,金属的导电性越好 |
|
| D. | 任何晶体都含化学键. |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
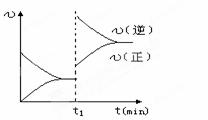
A.2SO2(g)+O2(g)  2SO3(g); △H<0
2SO3(g); △H<0
B. 4NH3(g)+5O2(g)  4NO(g)+6H2O(g); △H<0
4NO(g)+6H2O(g); △H<0
C. H2(g)+I2(g)  2HI(g); △H>0
2HI(g); △H>0
D.N2(g) +3H2(g)  2 NH3(g) △H<0
2 NH3(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
对于N2(g)+3H2(g) 2NH3(g),不能作为反应达到平衡状态的判断依据是( )
2NH3(g),不能作为反应达到平衡状态的判断依据是( )
A.恒容密闭容器中总压强不变 B.恒容密闭容器中混合气体的密度不变
C.生成氨气的速率与氨气分解的速率相等 D.N2、H2、NH3的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
对于密闭容器中进行的反应N2+O2
 2NO,下列条件能加快其反应速率的是
2NO,下列条件能加快其反应速率的是
A.增大体积使压强减小 B.体积不变,充入N2使压强增大
C.体积不变,充入He使压强增大 D.压强不变,充入气体Ne
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应:2M(g) N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
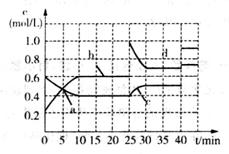
A.a 、b、c、d四个点中处于平衡状态的点是a、b
、b、c、d四个点中处于平衡状态的点是a、b
B.反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N
C.若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度
D.若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
今有乙酸和乙酸甲酯的混和物中,测得含碳的质量百分数为X,则混和物中氧的质量百分数为( )
A. (1-X)/7 B. 6(1-X)/7 C. 1-7X/6 D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)维生素C是一种水溶性的维生素,缺乏VC会使人患上 病。切取一片新鲜水果,向切面上滴加淀粉溶液和碘水,若出现 ,说明新鲜水果中含有VC,这是利用VC具有 (填“氧化”或“还原”)性质。
(2)经科学测定,人体平均含氧65%,含碳18%,含氢10%(以上均为质量分数),则三种元素中原子数目最多的是 (填元素符号)。
(3)某品牌抗酸药的主要成分有糖衣、氢氧化铝、淀粉。
写出该抗酸药发挥功效时的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com