
将3.2g铜片投入到一定量的浓HNO3中,当收集到1.792L的气体(已换算为标准状况)时,金属铜恰好全部溶解.(相对原子质量:Cu:64)
求:(1)反应中消耗HNO3的物质的量是多少?
(2)被还原的HNO3的物质的量是多少?
(3)转移电子的物质的量是多少?
考点:氧化还原反应的计算.
分析:n(Cu)=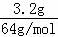 =0.05mol,收集得到气体物质的量=
=0.05mol,收集得到气体物质的量=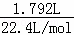 =0.08mol,根据转移电子守恒,如果生成的是NO,则n(NO)=
=0.08mol,根据转移电子守恒,如果生成的是NO,则n(NO)=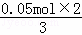 =0.033mol,如果生成二氧化氮,其物质的量=
=0.033mol,如果生成二氧化氮,其物质的量=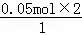 =0.1mol,0.033mol<0.08mol<0.1mol,所以生成的气体是二氧化氮、NO的混合物;
=0.1mol,0.033mol<0.08mol<0.1mol,所以生成的气体是二氧化氮、NO的混合物;
(1)参加反应的硝酸包含生成氮氧化物、生成硝酸铜的物质的量,所以消耗n(HNO3)=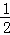 n[Cu(NO3)2]+n(NOx)=
n[Cu(NO3)2]+n(NOx)=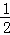 n(Cu)+n(NOx);
n(Cu)+n(NOx);
(2)被还原的硝酸生成氮氧化物,根据N原子守恒计算被还原硝酸物质的量;
(3)该反应中Cu失电子、硝酸得电子,可以根据Cu计算转移电子物质的量.
解答: 解:n(Cu)=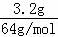 =0.05mol,收集得到气体物质的量=
=0.05mol,收集得到气体物质的量=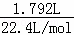 =0.08mol,根据转移电子守恒,如果生成的是NO,则n(NO)=
=0.08mol,根据转移电子守恒,如果生成的是NO,则n(NO)=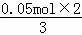 =0.033mol,如果生成二氧化氮,其物质的量=
=0.033mol,如果生成二氧化氮,其物质的量=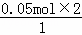 =0.1mol,0.033mol<0.08mol<0.1mol,所以生成的气体是二氧化氮、NO的混合物;
=0.1mol,0.033mol<0.08mol<0.1mol,所以生成的气体是二氧化氮、NO的混合物;
(1)参加反应的硝酸包含生成氮氧化物、生成硝酸铜的物质的量,所以消耗n(HNO3)=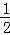 n[Cu(NO3)2]+n(NOx)=
n[Cu(NO3)2]+n(NOx)=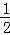 n(Cu)+n(NOx)=
n(Cu)+n(NOx)=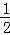 ×0.05mol+0.08mol=0.105mol,
×0.05mol+0.08mol=0.105mol,
答:反应中消耗HNO3的物质的量是0.105mol;
(2)被还原的硝酸生成氮氧化物,根据N原子守恒计算被还原硝酸物质的量=n(NOx)=0.08mol,
答:被还原硝酸的物质的量为0.08mol;
(3)该反应中Cu失电子、硝酸得电子,可以根据Cu计算转移电子物质的量=0.05mol×2=0.1mol,
答:转移电子的物质的量是0.1mol.
点评:本题考查氧化还原反应有关计算,为高频考点,明确各个物理量之间关系是解本题关键,利用原子守恒、转移电子守恒解答,题目难度不大.


科目:高中化学 来源: 题型:
已知H2CO3的酸性比HClO的酸性强,对反应:Cl2+H2O HCl+HClO达到平衡后 ,要使HClO浓度增加可加入 ( )
HCl+HClO达到平衡后 ,要使HClO浓度增加可加入 ( )
A.NaOH B.HCl C.CaCO3(固体) D.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
能用H++OH﹣=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应 B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应 D.二氧化碳通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
A.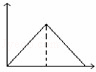 B.
B.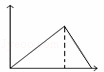 C.
C.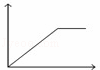 D.
D.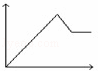
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于晶体的说法正确的是( )
|
| A. | 晶体中只要有阳离子就一定有阴离子 |
|
| B. | 氢键属于分子间作用力,不存在于分子内 |
|
| C. | 原子晶体的熔点一定比金属晶体的高 |
|
| D. | 构成分子晶体的微粒不一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com