
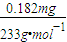 =7.811×10-7mol��ȡ����������SO2����Ϊ��
=7.811×10-7mol��ȡ����������SO2����Ϊ��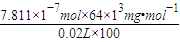 ��0.025mg/L��
��0.025mg/L��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
2012�궬�죬�ҹ����п�����Ⱦ״���ܵ����ǵ�ǿ�ҹ�ע���ڿ������������У�SO2��ָ���Ǻ������������û�����Ҫָ�ꡣΪ�˲ⶨ�����е�SO2����������λͬѧ�ֱ���������²ⶨ������
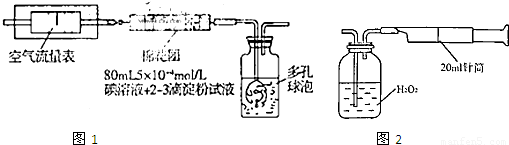
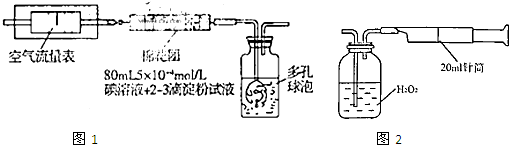
I��������ԭ������ͬѧ�������ͼ��ʾ��װ�ý���ʵ�飺
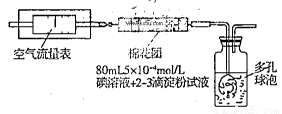
��1����ʵ����Ҫ80mL5��10-4mol��L�ĵ���Һ����ͬѧӦ����I2 g����ȷ��0.001����ѡ��_______mL������ƿ�������ơ���ʵ�����漰��������ԭ��Ӧԭ��Ϊ ���û�ѧ����ʽ��ʾ������ʵ��ԭ����������SO2�� �ԡ�
��2���ڼ�ͬѧ�������ҺŨ��ȷ��������ȡҩƷ��ʵ������и��ֶ��������������£���������װ�����ⶨ��SO2������Ȼ��ʵ�ʺ����ͣ���������п��ܵ�ԭ�� .
������������ͬѧ������ͼ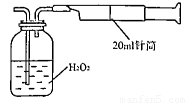 ��ʾ����װ�ý���ʵ�顣ʵ��������£���ͼ��װ���������ڹ��ƿ��ʢ��������H2O2ˮ��Һ���ù��Ϊ20mL����Ͳ����100�Σ�ʹ�����е�SO2��H2O2ˮ��Һ������գ�SO2+H2O2��H2SO4���������պ��ˮ��Һ�м���������BaCl2��Һ�����ɰ�ɫ�����������ˡ�ϴ�ӡ�����Ȳ������г������ð�ɫ����0.182mg��
��ʾ����װ�ý���ʵ�顣ʵ��������£���ͼ��װ���������ڹ��ƿ��ʢ��������H2O2ˮ��Һ���ù��Ϊ20mL����Ͳ����100�Σ�ʹ�����е�SO2��H2O2ˮ��Һ������գ�SO2+H2O2��H2SO4���������պ��ˮ��Һ�м���������BaCl2��Һ�����ɰ�ɫ�����������ˡ�ϴ�ӡ�����Ȳ������г������ð�ɫ����0.182mg��
��3��ȡ����������SO2����Ϊ mg/L����ȷ��0.001����
��4����֪��������BaSO3��KSPΪ5.48��10-7������������Һ��c��SO2-3��=6��3��10-8mol/L����ͬѧ��Ϊ����ʵ�鲻����H2O2����SO2��ֱ����0��1mol��L BaCl2��Һ������SO2���ɲ��������������������ݷ����������Ƿ���� .
III������������ͬѧֱ��ʹ��һ��SO2Ũ�����ܼ���Dzⶨ�����е�SO2���������ּ���������õ绯ѧԭ�������ݵ�ز���������ǿ����ȷ����SO2Ũ�ȵġ��õ���ܵĻ�ѧ��Ӧԭ��Ϊ��2SO2+O2+2H2O=2H2SO4
��5����д���õ�ظ����ĵ缫��Ӧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ĵ�ʡ��ɽ�ݸ����ڶ�������Բ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
2012�궬�죬�ҹ����п�����Ⱦ״���ܵ����ǵ�ǿ�ҹ�ע���ڿ������������У�SO2��ָ���Ǻ������������û�����Ҫָ�ꡣΪ�˲ⶨ�����е�SO2����������λͬѧ�ֱ�������������ֲⶨ������
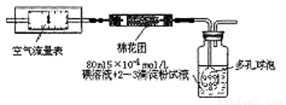
I��������ԭ������ͬѧ���ݻ�ѧ��Ӧԭ��SO2+I2+2H2O=H2SO4+2HI���������ͼ��ʾ��װ�ý���ʵ�飺
��1����ʵ����80mlŨ��Ϊ5��10-4mol/L�ĵ�
��Һ����ͬѧӦѡ�� ml������ƿ�������ơ�
��2�����ƿ��ʹ�ö�����ݵ�Ŀ���� ��
��3���ڼ�ͬѧ�������ҺŨ��ȷ��������ȡҩƷ�� ʵ������и��ֶ��������������£���������װ�����ⶨ��SO2������Ȼ��ʵ�ʺ����ͣ���������п��ܵ�ԭ������д����ԭ��
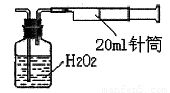
II������������ͬѧ����ʵ���ҳ���������ɼ���װ�òⶨ�����е�SO2������ʵ��������£�
������ʵ��װ��ͼ��װ���������ڹ��ƿ��ʢ��������H2O2ˮ��Һ���ù��Ϊ20ml����Ͳ����100�Σ�ʹ�����е�SO2��H2O2ˮ��Һ������գ�SO2+H2O2=H2SO4���������պ��ˮ��Һ�м���������BaCl2��Һ�����ɰ�ɫ������H2SO4+BaCl2=BaSO4��+2HCl���������ˡ�ϴ�ӡ�����Ȳ������г������ð�ɫ����0��18mg��
��4��ȡ����������SO2����Ϊ mg/L����ȷ��0.001����
��5���ֲ�������֪��������BaSO3��KspΪ5��48��10-7��������������Һ��c(SO32-)=6.3��10-8mol/L����ͬѧ��Ϊ����ʵ�鲻����H2O2����SO2��ֱ����0.lmol/L BaCl2��Һ������SO2���ɲ�������������Ϊ������ �����ȷ������ȷ�������������������ݼ������� ��
III������������ͬѧֱ��ʹ��һ��SO2Ũ�����ܼ���Dzⶨ�����е�SO2���������ּ���������õ绯ѧԭ�������ݵ�ز���������ǿ����ȷ����SO2Ũ�ȵġ��õ���ܵĻ�ѧ��Ӧԭ��Ϊ��2SO2+O2+2H2O=2H2SO4��
��6����д���õ�ظ����ĵ缫��Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com