
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |


科目:高中化学 来源:不详 题型:单选题
| A.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| B.升高NH4Cl溶液的温度,其水的离子积常数和pH均增大 |
| C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 |
| D.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH =" 40.69" kJ·mol-1 H2O(l) 的ΔH =" 40.69" kJ·mol-1 |
| B.已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6 |
C.已知: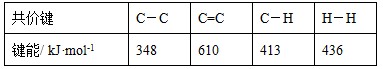 则可以计算出反应 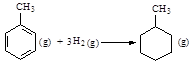 的ΔH为-384 kJ·mol-1 的ΔH为-384 kJ·mol-1 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
查看答案和解析>>
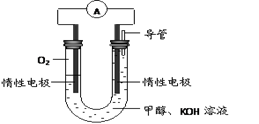
科目:高中化学 来源:不详 题型:填空题
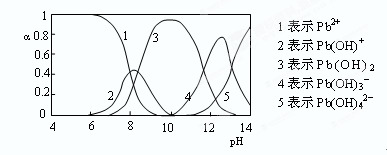
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
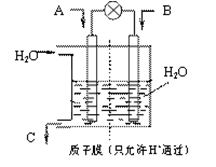
 N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,
N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H>0的反应,常温下一定不能自发进行 |
B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线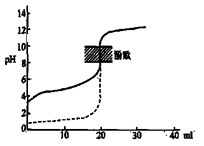 |
| C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 |
D.恒容密闭容器中进行的反应3A(g) 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2OH?+H2↑+Cl2↑
2OH?+H2↑+Cl2↑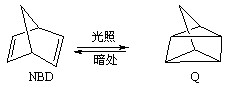 ,利用该反应可以贮存太阳能,则NBD的内能比Q的内能高
,利用该反应可以贮存太阳能,则NBD的内能比Q的内能高| 化学键 | N≡N | H?O | N?H | O=O |
| 键能/kJ·mol-1 | 945 | 463 | 391 | 498 |
 2NH3(g)+ 3/2O2(g);△H=+630kJ·mol-1
2NH3(g)+ 3/2O2(g);△H=+630kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (g)+
(g)+ 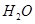 (g)=
(g)=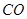 (g)+
(g)+ (g)
(g) 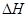 = +
= +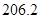
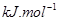
 (g)+
(g)+ 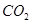 (g)=
(g)=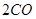 (g)+
(g)+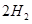 (g)
(g)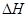 = +
= +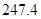
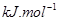
 (g)与
(g)与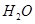 (g)反应生成
(g)反应生成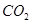 (g)和
(g)和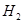 (g)的热化学方程式为 。
(g)的热化学方程式为 。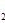 O的热分解也可得到H
O的热分解也可得到H ,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是 、 。
,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是 、 。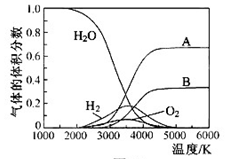
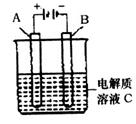
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率 |
| B.已知反应SO2(g)+H2O(g)=H2SO3(l),该过程熵值增大 |
C.下图可表示爆炸反应的能量变化曲线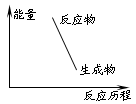 |
| D.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com