
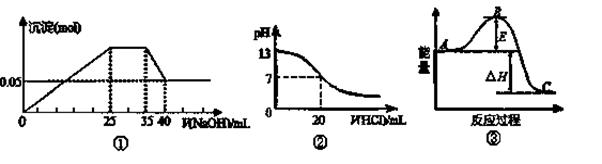
| A.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH 随加入酸体积的变化 |
| B.图①中使用的NaOH的浓度一定为2 mol/L |
| C.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶3∶2 |
D.图③中曲线表示3H2(g)+N2(g) 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 |


科目:高中化学 来源:不详 题型:填空题

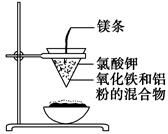
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分解反应 | B.化合反应 |
| C.置换反应 | D.复分解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铝溶液中加入过量氨水反应实质是: Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| B.在加入铝粉能放出氢气的溶液中:K+、NH4+、CO32—、Cl-一定能够大量共存 |
| C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 |
D.依据铝热反应原理,能发生反应:2Al+3MgO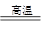 3Mg+Al2O3 3Mg+Al2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
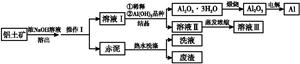
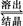 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
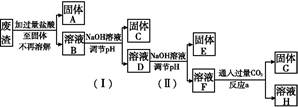
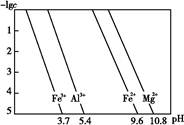
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com