解:(1)以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收;其中二氧化硫的催化氧化在催化剂表面和空气中的氧气接触反应,若气体中含有杂质气体容易使催化剂中毒,所以煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥;故答案为:接触室,防止催化剂中毒.
(2)依据图1中的转化关系,V
2O
5参与反应先做氧化剂把二氧化硫氧化为三氧化硫,本身被还原为图中产物V
2O
4;根据氧化还原反应的实质写出并配平a步化学方程式SO
2+V
2O
5?SO
3+V
2O
4;C是VOSO
4转化为SO
3,此过程需要重新生成催化剂V
2O
5,需要氧化剂完成,此过程中的氧化剂时氧气,根据化合价的变化写出C步化学方程式 4VOSO
4+O
2?2V
2O
5+4SO
3;故答案为:4VOSO
4+O
2?2V
2O
5+4SO
3(3)2SO
2+O
2
2SO
3 体系总压强为0.10M Pa,此时二氧化硫的转化率为80%
2SO
2 +O
2
2SO
3 起始量(mol) 2 1 0
变化量(mol) 2×0.8 0.8 2×0.8
平衡量(mol) 0.4 0.2 1.6
平衡时各物质的浓度为:[SO
2]=0.08mol/L,[O
2]=0.04mol/L,[SO
3]=0.32mol/L,代入平衡常数的计算式得到平衡常数K=
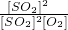
=400 L?mol
-1,
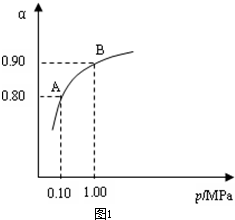
从图象中可以看出,常压SO
2就可以达到较高的转化率,压强的增加引起SO
2转化率的变化并不明显,所以工业上直接采用常压;
故答案为:400 L?mol
-1,使用常压SO
2就可以达到较高的转化率;
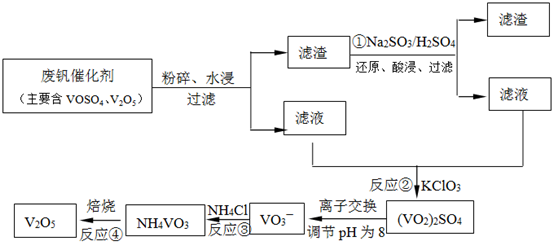
(4)依据离子交换法回收钒的新工艺流程图分析反应过程中:
①的目的是把难溶的五氧化二钒还原为溶于水的VOSO
4;
②的目的是用KClO
3还原为VOSO
4为(VO
2)
2SO
4;
③因为NH
4VO
3难溶于水,此步骤的目的是沉淀VO
3-④是分解NH
4VO
3得到V
2O
5;
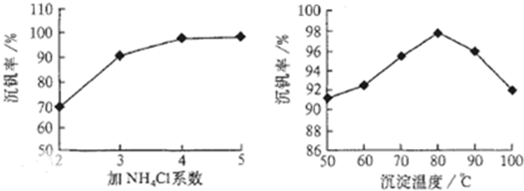
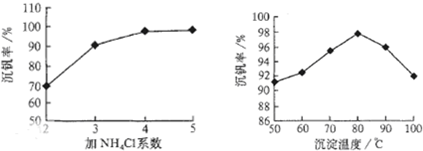
工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH
4Cl加入质量与料液中V
2O
5的质量比)和温度.根据图示分析数据,80℃时沉矾率最高为98%,所以加NH
4Cl的系数从图中读出为4;
故答案为:①②;V
2O
5+SO
32-+4H
+=2VO
2++SO
42-+2H
2O;4和80℃;
分析:(1)煅烧黄铁矿形成的炉气主要是二氧化硫气体,进入接触室前必须对气体继续除尘、洗涤、干燥,防止催化剂中毒,影响催化氧化的效果;
(2)根据催化剂参与反应过程生成的中间产物,分析催化剂参与反应,最终重新生成来书写化学方程式;
(3)根据化学平衡计算的三段式进行计算,压强的增加引起SO
2转化率的变化并不明显,所以工业上直接采用常压;
(4)根据流程中钒元素的存在化合物中的化合价的变化,判断出发生氧化还原反应的是①②;反应①是利用亚硫酸钠在酸性溶液中的还原性把难溶的V
2O
5转化为易溶于水的VOSO
4便于钒的提取;根据图1和图2分析坐标系中的表示含义,结合图②中的沉矾率在80度C时最大,约为98%,在图①中找到对应沉矾率98%下的控制氯化铵系数为4.
点评:本题考查了工业制硫酸的生产步骤、原理应用、注意问题,化学平衡的应用和条件选择,利用信息进行判断和书写化学方程式的能力,图象分析能力,提取钒元素的流程分析和氧化还原反应的应用.



 2SO3 体系总压强为0.10M Pa,此时二氧化硫的转化率为80%
2SO3 体系总压强为0.10M Pa,此时二氧化硫的转化率为80% 2SO3
2SO3 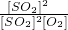 =400 L?mol-1,
=400 L?mol-1,


 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题: