
【题目】将3mol的NO2气体依次通入下列三个分别装有足量①NaHCO3饱和溶液②浓H2SO4③Na2O2的装置后,用排水法把残留气体收集起来,则收集到的气体是![]() 同温、同压下测定)
同温、同压下测定)
A.1molNOB.1mol NO2和0.05molO2
C.2mol NO2D.0.25mol NO2
【答案】D
【解析】
3molNO2气体通过饱和碳酸氢钠溶液,首先NO2气体与水发生反应3NO2+H2O=2HNO3+NO,反应中生成1molNO、2molHNO3,硝酸再与碳酸氢钠溶液发生反应HNO3+NaHCO3=NaNO3+CO2↑+H2O,反应中生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体通过过氧化钠,过氧化钠与二氧化碳发生反应2CO2+2Na2O2═2Na2CO3+O2,反应生成1molO2,氧气由一氧化氮发生反应2NO+O2=2NO2,反应中1molNO消耗0.5molO2,生成1molNO2,故从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,1molNO2消耗O2为1mol×![]() =0.25mol,故最终剩余的氧气为0.5mol-0.25mol=0.25mol,故最终收集到的气体是0.25molO2,故选D。
=0.25mol,故最终剩余的氧气为0.5mol-0.25mol=0.25mol,故最终收集到的气体是0.25molO2,故选D。


科目:高中化学 来源: 题型:
【题目】2013年6月《自然》刊波尔原子结构模型100周年。波尔在人类对原子结构的认识的历程上是非常重要的。以下关于人类对原子结构的认识错误的是( )

A. 汤姆逊发现电子
B. 道尔顿提出近代原子学说
C. 卢瑟福通过α粒子散射实验总结出原子结构葡萄干布丁模型
D. 玻尔首次将量子化概念应用到原子结构,并解释了原子稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列物质中:
(1)互为同分异构体的是______
(2)互为同素异形体的是_______
(3)互为同位素的是__________
(4)属于同一种物质的是______
(5)互为同系物的是__________ (填序号)
①液氯和氯气 ②白磷和红磷 ③(CH3)3CCH2CH3和(CH3)2CHCH(CH3)2 ④![]() 和
和![]() ⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
Ⅱ.现有6种物质:①MgCl2 ②HCl ③SO2 ④K2CO3 ⑤CaO ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨C2H6 ⑩H2O2
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是_______。
(2)只含离子键的离子化合物是______。
(3)含极性共价键的离子化合物是_________。
(4)含非极性共价键的离子化合物是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.由Na2CO3 + SiO2 ![]() Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。它在NCP疫情控制中发挥重要作用。
(1)工业生产双氧水常采用催化剂—乙基蒽醌法,其反应过程如图所示:

写出工业制备H2O2(1)反应的热化学方程式___。
(2)过氧化氢还可以通过电解-水解法制得。工业上用Pt作电极材料,电解硫酸氢铵饱和溶液得到过二硫酸铵[(NH4)2S2O8],然后加入适量硫酸以水解过二硫酸铵即得到过氧化氢。写出阳极的电极反应式___;整个过程的总化学方程式是___。
(3)某课题组在298K时研究H2O2+2HI=2H2O+I2反应速率的影响因素,实验结果如下表:
试验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
分析上述数据,写出反应速率与物质浓度的关系式___;该反应的速率常数(k)的值为___。
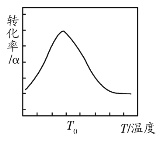
(4)过氧化氢是强氧化剂,在许多反应中有重要的应用。在一定温度下,将0.4molN2H4(g)和0.6molH2O2(g)装入2L固定容积的容器中,发生反应N2H4(g)+2H2O2(g)![]() N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
实验测得反应中N2H4(g)的转化率(α)与温度(T)的关系如图所示,分析说明温度高于T0时,N2H4(g)的转化率下降的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
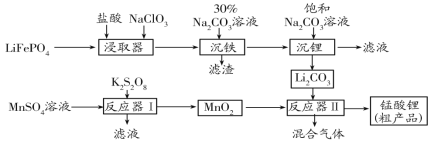
【题目】锰酸锂(LiMn2O4)是最早制得的具有三维锂离子通道的正极材料。以MnSO4和LiFePO4为原料制备锰酸锂的流程如图:
请回答下列问题:
(1)“沉铁”过程所得滤渣为白色固体,其主要成分是___。
(2)K2S2O8中S的化合价为+6价,则S2O82-中含过氧键的数目为__,反应器Ⅰ中发生反应的离子方程式__。
(3)反应器Ⅱ中反应温度为600~750℃。升温到515℃时,开始有CO2产生,比碳酸锂的分解温度(723℃)低得多,可能的原因是___。
(4)制得的锰酸锂粗产品中混有LiMnO2,写出在高温条件下反应产生LiMnO2的化学方程式___;称取一定量的锰酸锂粗产品于锥形瓶中,加入稀硫酸充分溶解,滴入含0.14molNa2C2O4的标准溶液时恰好完全反应,同时生成0.19molMn2+,则锰酸锂粗产品中LiMn2O4物质的量分数为___。 (MnO2-、Mn2O4-被还为Mn2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳香烃和氢气等化学用品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如图(部分反应产物及条件已略去):

已知:R—Cl![]() R—OH
R—OH
回答下列问题:
(1)A物质所含官能团的名称是___,反应⑥要发生需要试剂有__。
(2)M的结构简式是__,大量使用M产品会对环境造成的危害是__。
(3)反应③的化学方程式是___。
(4)化合物N在医疗上可以作为局部麻醉剂,N的化学名称是___。
(5)反应④的化学方程式是__;反应类型属于__反应。
(6)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5mol氨气 ②4g氦气 ③4℃时9mL水 ④0.2mol磷酸钠
A. ④③②①B. ①④③②C. ②③④①D. ①④②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com