
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池放电时,发生还原反应的物质是 (填字母,下同)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.放电时5.6g Fe全部转化为Fe(OH)2时,外电路中通过了0.2 mol电子
C.充电时阳极反应为Ni(OH)2+2OH-?2e-==NiO2+2H2O
D.充电时阴极附近溶液的碱性保持不变
(3)用此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,电解池的电极均为惰性电极。当溶液中的Cu2+ 全部转化成Cu时,阳极产生的气体在标准状况下的体积为 ;将电解后的溶液加水稀释至1L,此时溶液的pH= 。
(4)用此蓄电池进行电解,且电解池的电极均为铜电极,电解质溶液为浓碱液与NaCl溶液的混合液,电解一段时间后,同学们惊奇地发现,阳极附近不是生成蓝色沉淀,而是生成红色沉淀,查阅资料得知该红色沉淀是Cu2O。写出该阳极上的电极反应式: 。
(1)A (2)B、C (3)0.168L 2
(4)2Cu+2OH-?2e-=Cu2O+H2O
解析试题分析:(1)还原反应是化合价降低的物质发生的,NiO2生成Ni(OH)2化合价由+4降到+2,(3)电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL转移0.02 mol电子时先是氯离子失去电子,然后是水中OH-失去电子,各失去电子0.01 mol,产生Cl2 0.005 mol,O2 0.002 5 mol,共0.007 5 mol,体积为0.007 5 mol×22.4 L·mol-1="0.168" L, OH-失去电子0.01 mol同时产生0.01 mol H+,稀释至1 L时c(H+)="0.01" mol·L-1,pH为2。
(4)由信息可知电极反应为:2Cu+2OH-?2e- = Cu2O+H2O
考点:考查电化学原理及计算等相关知识。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:填空题
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。
甲池 乙池 丙池
请回答下列问题:
(1)甲、乙、丙三池中为原电池的是________(填“甲池”“乙池”或“丙池”)。
(2)丙池中F电极为________(填“正极”“负极”“阴极”或“阳极”),该池的总反应式为__________________________________________________。
(3)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开开关K。下列物质能使丙池恢复到反应前浓度的是________(填选项字母)。
| A.Cu | B.CuO | C.CuCO3 | D.Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课外活动小组同学用如图装置进行实验,试回答下列问题。 
(1)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(2)上述实验反应一小段时间后,再把开关K与a连接,则B极的电极反应式为 。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,则可以设想用如下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填”大于”或”小于”或”等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
⑤燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。液态肼(分子式N2H4)可以在氟气中燃烧生成氮气和氟化氢。利用肼、氟气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式:? ? .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如下图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
(1)电源电极X的名称为________。
(2)pH变化:A________,B________,C________。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液中OH-的物质的量浓度为________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式:
___________ 。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下_______L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为_______。 电池总离子反应方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极。
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电极b上发生的电极反应为___________________________________。
(2)电极b上生成的气体在标状况下的体积为__________________,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)_______________。
(3)电极c的质量变化是___________g,欲使电解后乙中的电解液恢复到起始状态,应该向溶液中加入适量的___________(填字母编号)。
| A.Cu(OH)2 | B.Cu2O | C.CuCO3 | D.Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源进行氯化镁溶液龟解实验,电解装置如图所示。
请回答下列问题:
(1)甲烷燃料电池负极的电极反应式为: 。
(2)闭合开关K后,a、b电极上均有气体产生,其中a电极上的气体可用 检验,b电极上得到的气体是 ,电解氯化镁溶液的离子方程式为 。
(3)若甲烷通入量为1.12 L(标准状况),且反应完全,则理论上通过电解池的电子的物质的量为 ,产生的氯气体积为 L(标准状况)。
(4)已知常温常压下,0.25molCH4完全燃烧生成CO2和H2O时,放出222.5kJ热量,请写出CH4燃烧热的热化学方程式 。
已知;①C(石墨)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
计算:C(石墨)与H2(g)反应生成1molCH4(g)的△H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是
造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
①该反应平衡常数表达式____________________________
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:_____________________。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mLlmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).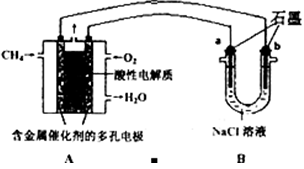
①甲烷燃料电池的负极反应式:______________________________________.
②电解后溶液的pH=____(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是________L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com