
【题目】根据所学知识填空。
(1)与标准状况下4.48L CO2中所含氧原子数目相同的水的质量是g;
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42﹣的物质的量浓度为mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为 , 气体所处的条件(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
药名 | 胃舒平 | 达喜 |
有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO34H2O |
相对分子质量 | 78 | 530 |
每片含有效成份的药量 | 0.245g | 0.5g |
估算10片胃舒平和5片达喜,含铝的物质的量较多的是 .
【答案】
(1)7.2
(2)![]()
(3)2
(4)24.5L/mol;不是
(5)10片胃舒平
【解析】解:(1)标准状况下4.48L CO2的物质的量为 ![]() =0.2mol,含有O原子的物质的量为0.4mol,所含氧原子数目相同的水的物质的量为0.4mol,则水的质量为0.4mol×18g/mol=7.2g;
=0.2mol,含有O原子的物质的量为0.4mol,所含氧原子数目相同的水的物质的量为0.4mol,则水的质量为0.4mol×18g/mol=7.2g;
所以答案是:7.2;(2)V L Fe2(SO4)3溶液中,含有Fe3+ m g,
则n(Fe3+)= ![]() =
= ![]() ,
,
根据化学式可得SO42﹣的物质的量为n(SO42﹣)= ![]() ×n(Fe3+)=
×n(Fe3+)= ![]() ×
× ![]() mol,
mol,
所以SO42﹣的物质的量浓度为c(SO42﹣)= ![]() =
= ![]() =
= ![]() mol/L,
mol/L,
所以答案是: ![]() mol/L;(3)9.2g氮的氧化物NOx中含氮原子0.2mol,则n(NOx)=n(N)=0.2mol,NOx的摩尔质量为:M(NOx)=
mol/L;(3)9.2g氮的氧化物NOx中含氮原子0.2mol,则n(NOx)=n(N)=0.2mol,NOx的摩尔质量为:M(NOx)= ![]() =46g/mol,
=46g/mol,
即NOx的相对分子质量为46,则14+16x=46,解得:x=2;
所以答案是:2;(4)0.4mol某气体的体积为9.8L,n= ![]() =
= ![]() =24.5,在标准状况下Vm=22.4L/mol,所以气体所处的条件不是标准状况;
=24.5,在标准状况下Vm=22.4L/mol,所以气体所处的条件不是标准状况;
所以答案是:24.5L/mol;不是;(5)设5片Al2Mg6(OH)16CO34H2O可以中和氢离子物质的量为X.
Al2Mg6(OH)16CO34H2O | ~ | 18HCl |
0.5g×5 | X |
![]() =
= ![]()
解得X=0.075mol,
Al(OH)3 | + | 3HCl | = | AlCl3 | + | 3H2O |
1 | 3 | |||||
x | 0.075mol |
x= ![]() =0.025mol
=0.025mol
故氢氧化铝质量=0.025mol×78g/mol,
5片达喜片相当于胃舒平的片数为: ![]() =8,故含铝的物质的量较多的是10片胃舒平;
=8,故含铝的物质的量较多的是10片胃舒平;
所以答案是:10片胃舒平.


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学反应的熵变的叙述正确的是
A.化学反应的熵变与反应的方向无关
B.化学反应的熵变直接决定了反应的方向
C.熵值增大的反应都是混乱度增大的反应
D.熵值增大的反应都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释正确的是 ( )
A. 物质的量就是物质的质量 B. 物质的量是一个独立的专有名词
C. 摩尔是物质的质量的单位 D. 摩尔质量等于相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①蔗糖 ②铝 ③Al2(SO4)3 ④CO2 ⑤H2SO4⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀盐酸
(1)上述物质中属于电解质的有:(填序号);
(2)区别⑦与⑧的方法:;
(3)③在水中的电离方程式为 , 17.lg该物质溶于水配成250mL溶液,物质的量浓度为mol.L﹣1;
(4)上述九种物质中有两种物质在水溶液中可发生反应且离子方程式为:H++OH﹣=H2O,该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如下:
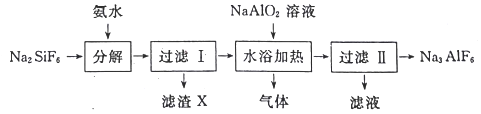
(1)分解过程发生的反应为:Na2SiF6+4NH3H2O═2NaF+4NH4F+X↓+2H2O。工业上把滤渣X叫白炭黑,其化学式为______________________。
(2)分解时白炭黑产率和冰晶石纯度与pH的关系如图所示,分解时需要控制溶液的pH=________;能提高其分解速率的措施有___________ (填标号)。
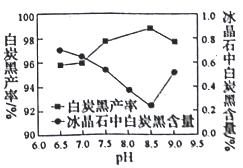
A.快速搅拌B.加热混合液至100℃C.降低氨水浓度
(3)流程中可循环利用的物质为_________(写化学式);冰晶石在电解冶炼铝中的作用是降低氧化铝的熔融温度、________________________和提髙产率。
(4)水浴加热过程中生成冰晶石的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A. △H4= 2/3(△H1+△H2- 3△H3) B. △H4= 2/3(3△H3-△H1-△H2)
C. △H4= 3/2(△H1+△H2- 3△H3) D. △H4= 3/2(△H1-△H2- 3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的叙述中正确的是( )
A. 溶液呈中性的盐一定是强酸强碱生成的盐
B. 所有盐溶液中c(H+)=c(OH-)
C. 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D. 强酸形成的盐的水溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 增大反应物浓度使单位体积内活化分子数和活化分子百分数均增加,有效碰撞增多,反应速率加快
B. 升高温度使单位体积内活化分子百分数大大增加,正反应速率增加,逆反应速率降低
C. 催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加
D. 增大压强一定能使单位体积内活化分子数增加有效碰撞增多,反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com