
| A. | ${\;}_{x}^{y}$R | B. | ${\;}_{z}^{y+x}$R | C. | ${\;}_{x+z}^{y}$R | D. | ${\;}_{x+z}^{y+x+z}$R |
分析 由离子化合物RClx知R离子带x个单位正电荷,即Rx+,R的核电荷数=x+z,质量数=核电荷数+中子数=(x+z)+y=x+z+y由离子化合物RClx知R离子带x个单位正电荷,即Rx+,R的核电荷数=x+z,质量数=核电荷数+中子数=(x+z)+y=x+z+y,根据原子符号的表示方法可得答案.
解答 解:由离子化合物RClx知R离子带x个单位正电荷,即Rx+,R的核电荷数=x+z,质量数=核电荷数+中子数=(x+z)+y=x+z+y由离子化合物RClx知R离子带x个单位正电荷,即Rx+,R的核电荷数=x+z,质量数=核电荷数+中子数=(x+z)+y=x+z+y,所以该同位素的符号是y+x+zx+zR,
故选D.
点评 本题主要考查了原子符号的含义以及阳离子中质子数=核外电子数-电荷数,质量数=质子数+中子数.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能发生反应 | |
| C. | 反应物和生成物所具有的总能量决定了放热还是吸热 | |
| D. | 吸热反应只能在加热的条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| B. | 醋酸能与NaHCO3溶液反应放出CO2 | |
| C. | 醋酸的导电性比盐酸溶液的弱 | |
| D. | 10 mL 1 mol•L-1醋酸恰好与10 mL1 mol•L-1NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04 mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
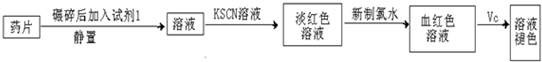

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
某气体的摩尔质量为Mg/mol,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X,则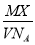 表示的是
表示的是
A、VL该气体的质量(以g为单位)
B、1L该气体的质量(以g为单位)
C、1mol该气体的体积(以L为单位)
D、1L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯无同分异构体 | |
| B. | 邻二甲苯只有一种 | |
| C. | 苯分子中各原子均在一个平面内,各键键角均为120° | |
| D. | 1mol苯最多只能与3mol H2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com